
Взгляд в будущее
Уже на склоне лет, 10 июля 1905 г. Д. И. Менделеев записал в своем дневнике: "По-видимости, периодическому закону- будущее не грозит разрушением, а только надстройки и развитие обещает...". Правота этих слов великого ученого подтверждалась многократно и будет подтверждаться впредь.
"Надстройки" и "развитие" можно понимать и в переносном, и в буквальном смысле. В первом случае ч речь идет о более глубоком проникновении в сущность явления периодичности, об открытии новых свойств и обнаружении новых закономерностей, управляющих поведением химических элементов. Во втором - о расширении сферы действия периодического закона и периодической системы вследствие синтеза новых химических элементов.
Мы хотим заглянуть в будущее периодического закона. Он - как могучее древо, у которого нет веточек, обреченных на засыхание. Напротив, оно то и дело выбрасывает новые молодые побеги. Чтобы, подобно ботанику, попытаться дать описание каждой ветви и веточки и предположить пути и особенности дальнейшего роста, нам потребовалось бы несколько толстых томов.
Поэтому мы остановимся лишь на том, что представляется нам наиболее важным.
Периодический закон атомных ядер.
Д. И. Менделеев сформулировал периодический закон, опираясь на особенности изменения (периодического) свойств химических элементов, расположенных по величинам атомных весов.
Г. Мозли доказал, что не атомные веса, а заряды ядер атомов управляют периодическим изменением свойств элементов.
Н. Бор объяснил причину периодичности тем, что периодически повторяются сходные типы электронных конфигураций атомов. Это было глубокое проникновение в сущность периодического закона. Открытый для химических элементов, он блеснул своей новой гранью: н проявил себя как периодический закон строения атомов. Когда было открыто явление изотопии, то атомное ядро привлекло пристальное внимание ученых. Ведь существование изотопов молено было объяснить, лишь опираясь на модель строения ядра. Сравнительно долгое время полагали, что ядра состоят из ядер водорода (протонов) и так называемых ядерных электронов. После открытия нейтрона (1932 г.) восторжествовала протонно-нейтронная схема строения ядер, которая принята до сих пор.
С каждым годом росло число изотопов, обнаруживаемых у стабильных элементов. Оказалось, более 3/4 из них имеют изотопы, причем некоторые- очень большое число. Например, олово имеет 10 изотопов. Затем ученые стали искусственно получать радиоактивные изотопы всех химических элементов с помощью различных ядерных реакций, подобных тем, которые мы описали в рассказе о синтезе новых элементов.
Всего теперь известно более 1900 различных атомных ядер (стабильных и радиоактивных) для 106 химических элементов. Сколько лее из них создала природа и сколько создано человеком? Такое сопоставление приводит к неожиданному и удивительному результату.
В природе найдено для 89 элементов 325 различных изотопов. Совсем еще недавно считалось, что в природе очень мало радиоактивных изотопов.
Было установлено, что 17 радиоактивных изотопов принадлежат ряду урана-238, а в ряду распада тория их 11, в цепочке распада урана-235 найдено 14 изотопов. Кроме них в природе были обнаружены радиоактивные изотопы-"одиночки": калий-40, рубидий-87 и несколько других.
Было установлено также, что в атмосфере непрерывно образуются и непрерывно исчезают углерод-14 и изотоп водорода - тритий. Остальные природные изотопы - около 280 - считались устойчивыми.
Но в последние десятилетия развитие измерительной техники привело к неожиданным результатам. Многие из тех изотопов, которые безусловно считались стабильными, оказались в действительности тоже неустойчивыми, радиоактивными. Таких уже найдено свыше 20.
Среди них есть и поистине удивительные: например, кальций-48, живущий 1021- 1022 лет, или изотоп свинец-204, распадающийся наполовину за 1,4*1018 лет.
Итак, в природе немногим более 300 стабильных и радиоактивных различных ядер. Но за время, истекшее с той поры, как были найдены пути к созданию новых радиоактивных элементов, человек уже сумел получить свыше 1600 новых радиоактивных ядер для всех без исключения элементов.
Будут ли установлены когда-нибудь какие-либо общие закономерности в тех свойствах вещества, которые зависят только от атомного ядра? Это очень большой и принципиально важный вопрос. От ответа на него зависит в будущем и познание природы человеком. Ответ на него - это путь к познанию строения атомного ядра, сегодня во многом еще недоступного.
Систематическое изучение свойств огромного числа стабильных и радиоактивных ядер всех природных и искусственных изотопов приводит к важному выводу, что в атомном ядре существуют энергетические уровни, подобно тому как существуют энергетические уровни в электронных оболочках и подоболочках атомов.
Сопоставление самых разнообразных свойств изотопов, зависящих от строения атомного ядра, с числом нейтронов или протонов, входящих в его состав, приводит к выводу, что в ядрах существуют нейтронные и протонные оболочки. В строении атомных ядер существуют периоды так же, как существуют периоды в строении атомных оболочек. Такая ядерная модель называется моделью ядерных оболочек или просто оболочечной моделью. И если внешние электронные оболочки становятся особенно устойчивыми, когда заряды ядер равны 2 (гелий), 10 (неон), 18 (аргон), 36 (криптон), 54 (ксенон) и 86 (радон), то внутриядерные нейтронные и протонные оболочки становятся наиболее устойчивыми, когда в атомных ядрах содержится 2, 8, 20, 50, 82 и 126 нуклонов (протонов или нейтронов). Эти удивительные числа (они недаром получили название магических чисел) определяют устойчивость атомных ядер и особую периодичность в изменении их физических свойств.
Изотопы с магическими числами протонов или нейтронов характеризуются особенно высокой распространенностью в природе, элементы с магическим числом протонов обладают особенно большим числом стабильных изотопов. Магические ядра наиболее "инертны" по отношению к захвату нейтронов при ядерных реакциях, они весьма прочны.
Все четыре цепочки радиоактивного распада урана, актиноурана, тория и нептуния заканчиваются на магических ядрах :20682РЬ,20872РЬ,20882РЬ,20983Вi.
Изучение таких свойств у атомных ядер, как магнитные свойства, абсолютная распространенность, дефект массы ядра, энергия связи, радиоактивность, показывает, что в них наблюдаются периодические изменения, обусловленные наличием в некоторых ядрах магического числа протонов или нейтронов. На этих устойчивых ядрах заканчиваются периоды в систематике атомных ядер, аналогично тому, как в таблице химических элементов периоды заканчиваются на атомах благородных газов.
Пока открыта и получена искусственно примерно лишь 1/4 всех ядер, принципиально способных к существованию. Поэтому рано еще говорить, что уже существует периодическая система атомных ядер, но явление периодичности оказывается справедливым не только для электронной оболочки атома, но и для атомного ядра, так недавно еще недоступного исследователю. Это указывает на то, что возможности, заключенные в периодическом законе, неисчерпаемы.
Где предел числа элементов?
Сегодня мы знаем о 106 химических элементах. А сколько еще будет сделано шагов в неведомую область трансуранов? Сколько раз еще ученые будут иметь возможность испытать радость по поводу синтеза нового элемента?
Период полураспада 106-го элемента по спонтанному делению составляет всего одну сотую долю секунды, или 10-2 с. Эта величина уже в значительной степени близка к предельной. Для того чтобы определить физическую и химическую природу нового элемента, такого промежутка времени едва-едва достаточно. Однако элемент с таким временем жизни не может, конечно, рассматриваться как последний в периодической системе.
Предел существования новых элементов должен наступить тогда, когда ядра их атомов распадаются фактически в момент образования (за время 10-20с). Так считают ученые. В принципе молено было бы считать, что осуществим синтез ядер с временем жизни гораздо меньшим, чем у элемента 106. Другое дело, что такие ядра просто невозможно было бы изучить.
Ученые давно задавались вопросом, какое же значение заряда ядра должно оказаться критическим. После успешного синтеза и изучения ядерных характеристик изотопов трансурановых элементов физики пришли к довольно неутешительному выводу: предел синтеза новых элементов должен наступить где-то в районе порядковых номеров 108-110. Считалось, что ядра с такими значениями Z будут абсолютно неустойчивыми. А следовательно, верхняя граница периодической системы элементов оказывалась очень близкой.
Но, как нередко бывает в науке, достаточно очевидные выводы вдруг становятся вовсе не очевидными.
Вернемся на несколько десятилетий назад, в ту эпоху, когда искусственного синтеза еще не было и ученые спорили, существуют ли в природе элементы тяжелее урана. Большинство полагало, что вряд ли: ведь эти элементы вследствие сильной радиоактивности давно должны были бы распасться, превратиться в более легкие. Но находились исследователи, которые отваживались на весьма дерзкие предположения.
В самом деле, среди всех природных радиоактивных элементов наиболее тяжелые (торий и уран) и самые долгоживущие. Значит, нельзя утверждать, что чем тяжелее элемент, тем сильнее ой проявляет радиоактивность. Возникал вопрос: почему ближайшие трансурановые элементы должны быть гораздо более коротко-живущими, чем уран? Какие основания для такого утверждения? Да, собственно, никаких. Зарождавшаяся ядерная физика не могла еще выдвинуть приемлемых объяснений. Если сравнить между собой периоды полураспада природных изотопов всех радиоактивных элементов от полония до урана, то мы получим хаотический набор чисел, не подчиняющийся никакой закономерности.
И все-таки физикохимик Рихард Свинне в 1913-1914 гг. такую закономерность отыскать попытался. Судьба этого почти забытого ныне латышского ученого сложилась так, что почти всю свою жизнь он работал в Германии. Свинне провел очень скрупулезный анализ поведения и свойств радиоактивных изотопов. В те времена было известно лишь два вида радиоактивных превращений: α-распад и β-распад. Так вот, Свинне обнаружил: в радиоактивных семействах наблюдается более или менее правильное чередование этих видов. Но главный его вывод заключался в том, что после нескольких короткоживущих изотопов появлялся как бы островок более долгоживущих. К одному из островков принадлежат торий и уран.
Придя к такому заключению, Свинне решил шагнуть за уран. По его выкладкам, следующих островков можно было ждать у неизвестных элементов с порядковыми номерами 98-102 и 108-110.
Никто не принял всерьез этих рассуждений. Но Свинне пошел еще дальше: он стал искать эти элементы в природе. Он исследовал пыль космического происхождения, собранную на ледниках Гренландии известным полярным путешественником Норденшель-дом. В 1925 г. Свинне сообщил: в рентгеновском спектре пыли обнаружены линии, которые, по-видимому, принадлежат элементу с порядковым номером 108 (!).
Лишь в середине 60-х годов вновь появилась на свет эта идея- гипотеза об островках относительной стабильности элементов с очень большими порядковыми номерами.
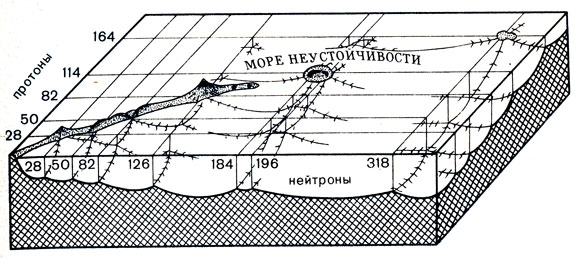
Такое аллегорическое изображение 'островков стабильности' в 'море неустойчивости' предложил американский ученый Г. Сиборг
Ученые решили распространить оболочечную модель ядра на области с высокими значениями Z. На языке математиков такой процесс называется экстраполяцией. С помощью экстраполяции физики решили рассчитать, какие еще числа протонов (Z) и нейтронов (N) в ядре могут быть магическими и как себя будут вести подобные ядра. Не окажутся ли они более устойчивыми к спонтанному делению, чем их соседи?
Расчеты удалось произвести с помощью быстродействующих электронно-вычислительных машин. И, как нередко бывает, выводы теоретиков несказанно удивили ученый мир. Вкратце выводы заключались в следующем.
Числа протонов Z=114, 126, 164 и даже 184 (!) и нейтронов N=184, 318 должны быть магическими, так как именно при этих значениях Z и N происходит заполнение очередных протонных и нейтронных оболочек. Следовательно, от соответствующих магических ядер можно ждать достаточно высокой стабильности по отношению к спонтанному делению. По расчетам, время жизни таких ядер превосходит 1015 лет.
Разными методами проверяли и перепроверяли себя теоретики и приходили к заключению, что нарисованная выше картина в целом представляется весьма достоверной. Настолько достоверной, насколько это позволяет считать современный уровень физических
знаний. Эти гипотетические элементы с магическими значениями Z и N назвали сверхэлементами.
К сожалению, сверхэлементы могут распадаться не только путем спонтанного деления. Они могут испытывать также α- или β-распад, кстати сказать, с гораздо большей вероятностью. А потому суммарное время жизни сверхэлементов оказывается существенно более низким. Оно может измеряться в минутах, часах, днях, годах, столетиях, быть может, тысячелетиях.
Даже если периоды полураспада сверхэлементов будут оцениваться минутами, то все равно открывается вполне реальная возможность их синтеза. И не только синтеза. Многие ученые не без основания полагают, что некоторые "мафусаилы" могут быть обнаружены в природных объектах, например в метеоритах, космических лучах, лунном грунте. К сожалению, весьма тщательные поиски, проводившиеся в последние 7-8 лет, не привели к каким-либо достоверным находкам. Объективно говоря, ядерный синтез сулит больше перспектив "прорыва" в области сверхэлементов.
Вы понимаете, какое огромное значение имел хотя бы единичный удачный "прорыв"?! Тем самым гипотеза об островках относительной стабильности превратилась бы в теорию, к которой пришлось бы отнестись с почтением даже самым сердитым скептикам. Но в данном случае синтез оказывается настолько сложным и капризным, что перед ним меркнут все те трудности, с которыми ученым уже пришлось столкнуться в ходе синтеза известных трансуранов.
Ближайшая цель- элемент № 114. На основании периодической системы можно детально предсказать его свойства. Это будет тяжелый аналог свинца, "эка-свинец", по терминологии Менделеева. Наиболее желательно синтезировать изотоп 298114, содержащий 184 нейтрона и 114 протонов, поскольку такое дважды магическое ядро должно быть особо устойчивым к спонтанному делению.
Путь синтеза может быть только один: бомбардировка мишеней из трансурановых элементов, например плутония, кюрия или фермия, ускоренными тяжелыми ионами, скажем, такими, как кальций, аргон, кремний.
Но оказывается, любые комбинации имеющихся в распоряжении исследователей мишеней с тяжелыми ионами не дают изотопов 114-го элемента с числом нейтронов, близким к 184. Можно рассчитывать на синтез изотопов, с гораздо меньшим N (числом нейтронов), а такие изотопы будут более неустойчивы.
Напротив, изотоп элемента № 126 с массовым числом 310 (т. е. со 184 нейтронами) теоретически получить возможно, но он, по всей вероятности, будет в сильной степени β-активен, с малым периодом полураспада. Коль скоро его удастся синтезировать, то встанет задача разработки специальной методики для определения его химической природы. Это требует предварительного прогнозирования важнейших свойств 126-го элемента. Но если мы спросим себя, какими именно могут быть эти свойства, аналогом какого элемента будет элемент № 126, то должны признаться, что сколь-либо определенного ответа наука дать не может. Почему - вы узнаете в следующем разделе.
Наконец, академик Г. Н. Флеров выдвинул весьма необычную идею синтеза сверхэлементов. Он предлагает, например, облучать уран ионами урана. Возникающее при их слиянии ядро-монстр испытает моментальное самопроизвольное деление, причем среди осколков деления окажутся с большой вероятностью изотопы 114-го и 126-го элементов.
Что касается элементов с Z=164 и 184, возле которых ученые предполагают существование других островков стабильности, то в данном случае просто еще рано обсуждать какие-либо практические шаги. Пока очевидно, что проблема верхней границы системы остается одной из важнейших загадок. И разгадывать ее придется будущим поколениям.
Размывание периодичности.
Вернемся к тем страницам книги, на которых было рассказано, как устроена периодическая система элементов. Ее строение подтверждает, что она действительно периодическая.
В самом деле, начиная с первого ее периода в каждом из периодов повторяются периодически s-элементы; начиная со второго - р-элементы, начиная с четвертого - d-элементы. И особенно характерно то, что границы между отдельными электронными оболочками и подоболочками очень четкие. То есть их построение начинается именно у атомов тех элементов, как это предсказывает теория периодической системы. И завершается построение там, где ему следует завершиться в соответствии с теорией.
Такая гармония царит в системе по пятый период включительно. В шестом появляется некоторая неувязка. Она всего лишь одна, но на нее стоит обратить внимание. Прочитав снова ту страницу книги, где речь идет о редкоземельных элементах, вспомните, как происходит заполнение 14-ю электронами 4f-подоболочки. Во-первых, первый 4f-электрон появляется не у лантана (Z = 57), как следовало бы, а у следующего - церия (Z = 58); во-вторых, построение 4f-подоболочки прерывается у гадолиния (Z = 64), где снова появляется 5d-электрон. А отсюда и следует то, что граница между 5d-и 4f-подоболочками словно бы оказывается размытой. Внешне это обстоятельство проявляется в следующем - в существовании совокупности пятнадцати редкоземельных элементов, очень сходных по химическим свойствам (от лантана до лютеция), хотя заполнение 4f-подоболочки происходит на протяжении тринадцати элементов (ведь гадолиний-то "выпадает из игры"). Поэтому принятое размещение редкоземельных элементов в периодической системе (когда их все помещают в одну клетку с лантаном, а ряд лантаноидов расшифровывают внизу таблицы) оказывается, пожалуй, единственным удовлетворительным способом.
Давайте посмотрим, как устроен седьмой период. Видите ряд элементов, расположенный в самом низу таблицы, - актиноиды. Так же как 14 лантаноидов из шестого периода все помещаются в одной-единственной клетке лантана, так и 14 актиноидов все занимают клетку актиния в седьмом периоде. По отношению к лантаноидам этот прием в общем правилен, так как 14 элементов - от церия до лютеция - очень похожи друг на друга и на лантан.
А в случае актиноидов такого химического подобия нет. В первой половине этого семейства каждый элемент имеет самостоятельное лицо. Торий непохож на актиний, уран отличается и от своего левого соседа - протактиния и от правого - нептуния. Свои отличные особенности у плутония, америция и кюрия.
Для лантаноидов особенно характерна почти постоянная валентность, она равна 3, и только некоторые редкоземельные элементы могут быть четырехвалентными (церий, празеодим, тербий) или двухвалентными (самарий, европий, иттербий). Трехвалентное состояние самое устойчивое.
Каждый из актиноидов располагает весьма богатым арсеналом валентностей. Например, уран может иметь валентности, равные 2, 3, 4, 5 и 6. Нептуний и плутоний идут еще дальше. В 1967 г. советские ученые Н. Н. Крот и А. Д. Гельман обнаружили, что эти элементы могут быть семивалентными, а в 1974 т. были получены соединения семивалентного америция. Лишь после кюрия, актиноиды, образно говоря, становятся ровнее в своем химическом поведении, трехвалентное состояние оказывается преобладающим. Но и здесь есть сюрпризы. Мы преследовали одну цель: убедить вас, что считать актиноиды семейством химических элементов, подобным лантаноидам, ни в коем случае нельзя. И само название "актиноиды" означает "подобные актинию". А разве торий, или уран, или нептуний похожи на актиний, который иначе как в трехвалентном состоянии не встречается? Название "актиноиды" предложил в 1945 г. американский ученый Г. Сиборг, но в те времена трансурановых элементов было еще очень мало, а свойства их только начинали изучать.
А в итоге получается: в седьмом периоде системы элементов существует большая их совокупность, которая не может быть размещена в таблице так, чтобы химик с этим размещением безоговорочно согласился. Теперь посмотрите: в 104, 105 и 106-й клетках таблицы помещены три синтезированных химических элемента. Курчатовий, как показала оценка его химической природы, похож: на гафний, а 105-й на тантал. Но ведь многие десятилетия аналогами гафния и тантала рассматривались соответственно торий и протактиний. И ниже вольфрама стоял уран. Никто такого расположения не оспаривал вплоть до появления идеи о семействе актиноидов.
Какой же элемент ставить под гафнием: торий или курчатовий? Какой из двух элементов: протактиний или 105-й считать непосредственным аналогом тантала? Стройность планировки здания периодической системы в его нижнем этаже - седьмом периоде заметно нарушается. Природа-архитектор эту планировку весьма усложнила. Рамки менделеевской таблицы оказываются слишком жесткими, чтобы безупречно разместить элементы с порядковыми номерами от 90 до 106 и далее. Как же объяснить, почему элементы седьмого периода проявляют столь своеобразные свойства, что его аналогия с шестым заметно нарушается? Прежде всего резким размыванием границы между 6d- и 5f-подоболочками. Эти подоболочки у элементов от тория до америция почти не отличаются друг от друга, т. е. электроны, заполняющие их, характеризуются очень близкими значениями энергии. Стало быть, атомы актиноидов получают возможность проявлять различные валентности. А следовательно, их химия значительно богаче, чем химия лантаноидов.
Явление, когда четкие границы между соседними подоболочками отсутствуют, нарушаются, и это нарушение сказывается на свойствах соответствующих элементов, может быть названо размыванием периодичности.
Компьютеры рассказывают о химии, которой еще нет.
Если вы не знаете, то поясним, что компьютерами называются счетные машины. Это общее название различных счетных устройств и механизмов, включая быстродействующие электронно-вычислительные машины. Компьютеры могут очень многое. Без них современная наука и техника не могли бы сделать и шагу. Они оказывают человеку величайшую помощь, позволяя ему делать прогнозы в самых различных областях.
Мы уже рассказывали, что электронно-вычислительные машины помогли ученым предсказать существование островков относительной стабильности у ядер с очень большими значениями Z.
Было заманчивым попытаться предсказать, какими свойствами могли бы обладать сверхэлементы, скажем элементы восьмого периода периодической системы. С помощью компьютеров физики рассчитали (именно рассчитали!) важнейшие свойства этих элементов. Так возникло целое научное направление, которое один ученый очень метко, но и не без иронии назвал компьютерной химией.
Посмотрим, какие сведения добыла эта химия относительно элементов восьмого периода. Этот период, полагают ученые, должен содержать 50 элементов. Начинается щелочным металлом с порядковым номером 119 и заканчивается инертным газом с порядковым номером 168. На языке электронных оболочек его строение может быть записано так:
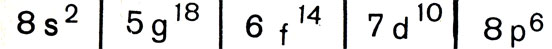
Вы видите, что в восьмом периоде должны появиться элементы, подобных которым не было ни в одном из предшествующих периодов. Это 5д-элементы. Они отвечают значению орбитального квантового числа l = 4, и, следовательно, их может быть 18, не более и не менее. Но если появление 4f-электронов, как мы знаем, отвечало построению третьей снаружи оболочки, то появление 5g-электронов соответствует построению уже четвертой снаружи оболочки. Они завершают О-оболочку с главным квантовым числом n = 5, которая начала строиться давным-давно, в атоме рубидия с Z = 37. 5O-электроны спрятаны в атоме еще глубже, чем 4f-электроны, а следовательно, их влияние на химические свойства элементов должно быть еще меньше. Поэтому молено было бы думать, что 5g-элементы должны оказаться химически еще более подобными, чем лантаноиды.
Уже появлявшийся в нашем рассказе сверхэлемент с Z=126 принадлежит именно к 5g-элементам. Оставаясь в рамках логики предыдущих рассуждений, позволительно было бы думать, что его основное валентное состояние равно + 3, и, подобно своим сородичам, он может относиться к третьей группе системы. Точно так же другой гипотетический сверхэлемент с Z=164 следовало бы отнести к 8р-элементам, а по свойствам он оказался бы еще более тяжелым, нежели 114-й, аналогом свинца. Когда вмешались компьютеры, от этих, казалось, логичных рассуждений не осталось и следа.
Компьютеры рассчитали, что последовательность построения электронных подоболочек в атомах элементов восьмого периода должна быть чрезвычайно сложной. Размывание периодичности здесь становится, скорее, правилом, чем отклонением от правила, как это было в шестом и седьмом периодах, где в целом еще сохранялся общий порядок.
Рассказывать в деталях, как все это происходит, дело сложное, да и едва ли нужное. Далее специалисты далеко не до конца могут распутать все хитросплетения электронных конфигураций. Поэтому мы скажем лишь об основных выводах компьютерной химии.
Вывод первый. У элементов с Z = 121 и 122 в электронных конфигурациях появляются не 5g-, не 6f- и даже не 7d-электроны. Появляются два 8р-электрона. Вспомните: р-электроны появляются сразу после s-электронов только во втором и третьем периодах периодической системы.
Вывод второй. Далее следует настоящая мешанина из электронов, принадлежащих к различным подоболочкам, и элемент с Z = 164 может оказаться опять-таки удивительным. У него завершается построение 7d-подоболочки, а внешние электроны (8s и 8р) оказываются настолько прочно связанными с ядром, что их участие в химических связях исключено. Поэтому элемент с Z=164 должен быть весьма химически недеятельным элементом. Но на этом удивительное не кончается, как свидетельствует...
Вывод третий. У 165-го элемента и у соседнего с ним 166-го появляются... 8p-электроны. И это при всем при том, что построение 8р-подоболочки (она-то должна содержать шесть электронов) еще не завершилось. Что лее это означает? А то, что восьмой период заканчивается у элемента с Z= 164, а не у 168-го, как можно было предполагать.
Как свидетельствует вывод четвертый, чудеса продолжаются и дальше: элементы 167 и 168 это 9р-элементы, и лишь только в интервале порядковых номеров 169-172 завершается (наконец-то!) 8р-подоболочка. И образуется, таким образом, совершенно удивительный девятый период:
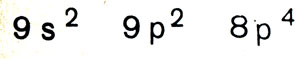
Такой же короткий, содержащий также 8 элементов, как второй и третий периоды.
Ситуация, прямо скажем, сказочная. Если ученые, закладывая программу в компьютеры, ничего не напутали и дело в действительности должно обстоять именно так, то мы можем заметить: открытое Д. И. Менделеевым явление периодичности оказывается гораздо более глубоким и сложным, чем это можно было представить всего лишь несколько лет назад.
Совершенно необычный, полный сюрпризов и загадок мир удивительных химических элементов и их соединений - вот что в перспективе может ожидать ученых. Дело за "немногим": на эксперименте доказать, что гипотеза об островках относительной стабильности - это не научный миф XX столетия, получить сверхэлементы и изучить их свойства.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'