
Изменение растворимости твердых веществ при изменении температуры
Цель работы. На основании опытов выясните, как изменится растворимость селитры и гашеной извести при повышении или понижении температуры.
Выполнение работы.
В колбу внесите чайную ложечку калиевой селитры и влейте 20 мл (полную пробирку) воды, хорошенько взболтайте, заметьте, сколько (приблизительно) селитры растворилось в воде при обыкновенной температуре. Затем внесите еще ложечку селитры и нагрейте колбу с раствором до 50°С. Если селитра растворится, добавьте в горячий раствор еще чайную ложечку селитры и хорошенько взболтайте.
Отметьте, сколько (приблизительно) растворилось селитры при 50°С. Узнайте, на сколько увеличилась растворимость селитры при нагревании с 20 до 50°С. Для этого раствор, насыщенный при 50°С, влейте в пробирку, которую затем опустите в стакан с водой, имеющей комнатную температуру (20°С).
Наблюдайте выпадение кристаллов. По количеству кристаллов, выделившихся из раствора при его охлаждении, можно судить о разнице растворимости селитры при 20°С и при 50°С.
Кратко опишите опыт и сделайте вывод об изменении растворимости селитры в зависимости от температуры. В заключительной беседе после выполнения учащимися опытов должны быть уточнены понятия "коэффициент растворимости", "насыщенный раствор", чтобы учащиеся с большой долей самостоятельности могли формулировать определение этих понятий.
Хорошей иллюстрацией зависимости растворимости твердых веществ от температуры может служить опыт; сравнение количеств кристаллов калиевой селитры, выпадающих из одинаковых объемов растворов селитры, насыщенных при разных температурах и охлажденных до комнатной температуры.
Если ограничиться изучением растворимости при разных температурах только одного твердого вещества, например селитры, то у учащихся образуется понятие только о прямой зависимости растворимости всех твердых веществ от температуры, что не соответствует действительности. Поэтому нужно привести примеры обратной зависимости, т. е. уменьшения растворимости твердых веществ при повышении температуры. Таким примером может быть растворимость гидроокиси кальция или сульфата кальция. В этом можно убедиться при нагревании раствора гипса или извести, насыщенных при обыкновенной температуре. Но эти опыты малопригодны для демонстрации, так как издали, трудно обнаруживать помутнение раствора. Поэтому следует предложить самим учащимся проделать этот опыт. Но в Данном случае должен быть применен иллюстративный метод в руководстве этой работой учащихся, так как они еще не владеют таким умением наблюдать, чтобы обнаружить самостоятельно без предупреждения учителя выделение из раствора очень мелких кристалликов твердого вещества.
После того как учащиеся узнали об изменении растворимости твердых веществ в воде в зависимости от изменения температуры, естественно возникает вопрос о мере растворимости, что в свою очередь связано с понятием "насыщенный раствор". При формировании этого понятия, нужно предупредить распространенную ошибку учащихся, состоящую в том, что раствор, находящийся над нерастворенной частью вещества, они считают пересыщенным. Чтобы устранить эту ошибку, нужно показать опыт выпадения осадка из перенасыщенного раствора при внесении в него "затравки". Для демонстрации этого опыта можно рекомендовать пересыщенные растворы гипосульфита или уксуснокислого натрия. Если усвоены свойства насыщенных, ненасыщенных и пересыщенных растворов, то можно еще несколько углубиться в процесс растворения твердых веществ - ознакомить учащихся с явлением подвижного равновесия между осадком и растворенным веществом в насыщенном растворе. Этот анализ процесса растворения на основе атомно-молекулярной теории важен еще и как подготовка учащихся к изучению впоследствии обратимых реакций, протекающих в растворах.
Растворимость в воде жидкостей и газов. Изучение процесса растворения, формирование понятия о растворах и растворимости происходят на примерах растворения в воде главным образом твердых веществ. Однако нужно, хотя и кратко, ознакомить учащихся и с растворимостью в воде жидкостей и газов.
В качестве примеров можно показать опыты растворения Б воде спирта (хорошая растворимость), эфира (сравнительно плохая растворимость) и растительного масла (практически нерастворимое вещество). При разборе первых двух примеров следует отметить и растворимость воды в спирте и эфире, взаимную растворимость воды и спирта. Присутствие воды в эфирном слое, полученном после отделения его от воды, можно обнаружить при помощи прокаленной сернокислой меди (появление голубой окраски) или при помощи сухой бумажки, пропитанной раствором соли кобальта (розовая окраска). Чтобы показать нахождение эфира в водном слое, можно нагреть его в пробирке и выделяющиеся пары эфира поджечь (рис. 45).
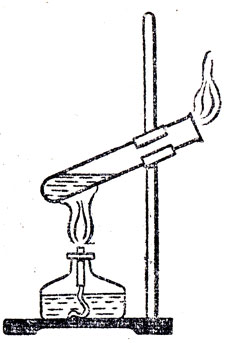
Рис. 45. Горение паров эфира
В качестве примера хорошо растворимого в воде газа можно показать растворимость хлористого водорода. Этот опыт используется при ознакомлении учащихся с соляной кислотой: На данном же уроке можно отметить только факт хорошей растворимости и отметить обратную зависимость растворимости от температуры. Уменьшение растворимости газов при повышении температуры можно показать также на примере уменьшения растворимости воздуха. Для этого можно показать опыт (рис. 46). Колбу 1 емкостью 150-200 мл наполняют водой и закрывают пробкой, в которую вставляют воронку. В воронку тоже наливают воду и помещают пробирку 2, наполненную водой и опрокинутую вверх дном. Прибор укрепляют в штативе, как указано на рисунке, а колбу нагревают. Выделяющийся из воды воздух выходит через узкую часть воронки и собирается в пробирке. Если пробирка градуирована, то можно узнать объем выделившегося воздуха и вычислить растворимость его в процентах (объемных).
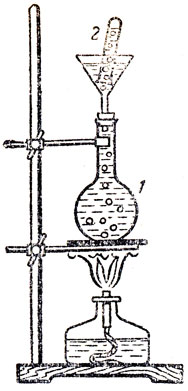
Рис. 46. Выделение растворенного в воде воздуха при нагревании
В заключение остается сравнить процесс растворения с химическим явлением, рассмотреть его с точки зрения атомно-молекулярной теории и сформулировать определение раствора. Для выявления сходства между растворением и химической реакцией необходимо отметить выделение или поглощение теплоты при растворении различных веществ и появление таких свойств у растворов, каких нет ни у растворенного вещества, ни у растворителя. Тепловой эффект процесса растворения учащиеся могут наблюдать при растворении едкого натра (разогревание) и поваренной соли или селитры (охлаждение).
Демонстрируя отсутствие электропроводности чистой воды, сухой соли и хорошую электропроводность раствора соли, учитель может выявить такое свойство раствора, какого нет ни у растворителя, ни у сухого растворяемого вещества.
Прибор для обнаружения электропроводности жидкостей изображен на рисунках 47, 48. Чтобы показать различие между растворением и химической реакцией, следует указать на то, что в растворе между количествами, растворителя и растворенного вещества не наблюдается той определенности и постоянства весовых отношений, какое существует у реагирующих веществ. Из этих Сопоставлений учащиеся должны сделать вывод, что процесс растворения веществ занимает промежуточное положение между химической реакцией и механическим перемешиванием веществ. На этом основании его следует отнести к физико-химическим явлениям.
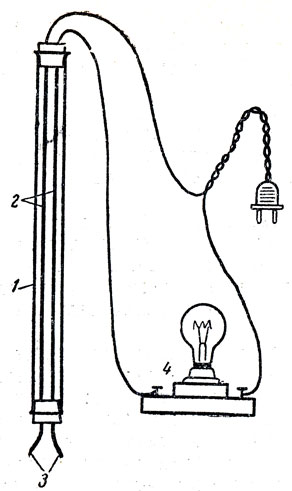
Рис. 47. Прибор для обнаружения электропроводности жидкостей: 1 - стеклянная Трубка длиной 20-30 см, 2 - изолированные электрические провода, 3 - обнажённые концы электрического провода, 4 - патрон с электрической лампочкой
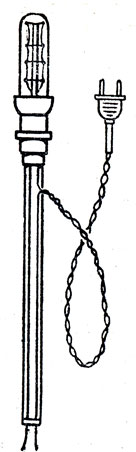
Рис. 48. Прибор дли обнаружения электропроводности жидкостей: патрон прикреплен к трубке из пластмассы или стекла
Концентрация растворов. В программу химии VII класса включено ознакомление с концентрацией растворов, выражаемой в процентах. Включение этого учебного материала в программу вызвано требованиями жизни: с приготовлением растворов различной концентрации и со связанными с этим расчетами приходится иметь дело в различных производствах и в быту.
Эта учебная задача сравнительно проста, и на ее решение не требуется много времени, если рассматривать ее как задачу арифметическую, какой она по существу и является. Поэтому перед уроком на эту тему нужно предложить учащимся повторить способы решения задач на смешение. Чтобы это задание пошло по должной линии, нужно договориться с учителем математики и поручить ему это дело. (О способах решения таких задач см. часть первую гл. III этой книги.)
Роль воды в природе и использование ее человеком. Изучение воды и растворов заканчивается беседой о роли воды в природе и использовании ее человеком. Это занятие можно разделить на две части: самостоятельную работу учащихся с учебником и заключительную беседу.
В результате чтения учебника должен быть составлен конспект, в котором кратко описано: а) изменения, производимые водой в неживой природе; б) значение воды для жизни растений и животных; в) использование человеком воды, основанное на механическом ее действии, на химических свойствах и на действии как растворителя.
Во время заключительной беседы следует рассмотреть процесс растворения как измельчение растворяемого вещества до такой степени дробления, какой нельзя достичь на механических дробилках и мельницах. Чтобы учащиеся осознали значение такого измельчения веществ для химических реакций, необходимо напомнить им, что химическое взаимодействие происходит только при контакте атомов или молекул реагирующих веществ. Поэтому реакции в растворах проходят, как правило, значительно быстрее, чем в смеси порошков. В этом учащиеся могут убедиться на следующем опыте (рис. 49): в колбу помещают небольшое количество смеси соды и какой-либо твердой, растворимой в воде кислоты (щавелевой или лимонной); конец газоотводной трубки должен быть погружен в стаканчик с известковой водой. Если сода и кислота не содержат влаги, реакция проходит медленно. Но достаточно прилить из капельной воронки несколько капель воды, как обнаруживается быстрое выделение углекислого газа, от взаимодействия которого с известковой водой образуется муть.
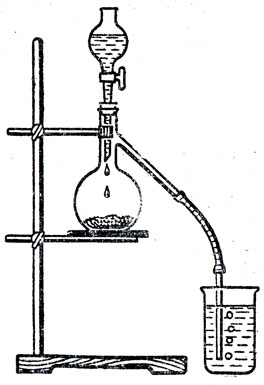
Рис. 49. Сравнение скоростей химической реакции, происходящей между двумя твердыми веществами и теми же веществами в растворе
В беседе об использовании воды человеком можно кратко напомнить учащимся о пути, пройденном человечеством от боготворения воды к ее использованию на основе изучения ее механических действий в жидком, твердом и газообразном состоянии, ее свойств как растворителя, а также к использованию воды как сырья в химическом производстве. Говоря о применении воды для удовлетворения бытовых нужд, необходимо ознакомить учащихся с очисткой питьевой воды в городах. Желательно для этой беседы приготовить или модель, или плакат городской водоочистительной станции. Затем следует рассказать о получении дистиллированной воды в химических и медицинских лабораториях, на теплосиловых станциях для питания паровых котлов высокого давления. При наличии в школе электрического освещения и водопровода можно предложить учащимся изготовить под руководством преподавателя автоматически действующий дистилляционный прибор с электрическим нагревом.
Отмечая жизненно важное значение воды для человека, нельзя не отметить и того вреда, который приносит ему вода как стихия природы, как химический реагент, портящий металлические изделия, как условие гниения и порчи продуктов питания и вещей домашнего обихода. Эти замечания позволяют рассматривать задачи науки (химию и биологию) не только в отыскании полезных для человека веществ и явлений в природе, но и разработке способов борьбы с вредными для него процессами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'