
Глава II. Строение вещества
Значение темы в курсе химии. Изучение строения вещества имеет большое значение для материалистического миропонимания учащихся и для усвоения основ современной химии.
Техника физического и химического эксперимента, применяемого в изучении строения атома, достигла такого совершенства, что теперь представляется возможным достаточно убедительно доказать реальность существования электронов, альфа-частиц и других структурных единиц веществ, о существовании которых раньше даже и не предполагали.
При изучении этой темы учащиеся не только убеждаются в справедливости учения о прерывистом строении вещества, но и узнают о существовании новых частиц, качественно отличных от атомов и молекул. Они приобретают важные сведения, необходимые для правильного с точки зрения диалектического материализма суждения о дискретности материи: "Новая атомистика отличается от всех прежних тем, что она... не утверждает, будто материя только дискретна, а признает, что дискретные части различных ступеней (атомы эфира, химические атомы, массы, небесные тела) являются различными узловыми точками, которые обусловливают различные качественные формы существования всеобщей материи..."*.
* (Ф. Энгельс. Диалектика природы, М., Политиздат, 1969, стр. 257.)
До ознакомления с электронной теорией учащимся были известны некоторые понятия о молекулах и атомах, а также и о качественном отличии молекул от простой суммы атомов. При изучении электронной теории они знакомятся с новыми для них "узловыми точками": электроном, нейтроном, протоном.
Изучение электронной теории приближает курс химии к современному состоянию науки, позволяет с новых позиций рассматривать учебный материал, содействует более глубокому усвоению учащимися некоторых разделов физики. Следовательно, это имеет большое значение для формирования естественно научного мировоззрения.
Человечество вступает в эру атомной энергии, поэтому элементарные сведения о строении атомов и свойствах более мелких структурных единиц материи должны быть включены в круг общеобразовательных знаний, которыми вооружает учащихся средняя школа.
Объем учебного материала и последовательность изучения. Соответственно развитию науки изменяется и содержание курса химии высшей и средней школы. То, что несколько лет назад допускалось только в учебниках для высшей школы, теперь вошло в курс химии средней школы.
На основе более глубоких знаний о строении вещества у учащихся должно измениться понятие о химическом элементе, и периодическая система должна получить новое освещение с точки зрения электронной теории. Изучение электронной теории в средней школе включает такие разделы: зависимость свойств элементов от структуры электронной оболочки атомов (от числа и расположения электронов), ознакомление с основными видами химической связи. После рассмотрения этого учащиеся более глубоко понимают сущность химических реакций, окислительно-восстановительных процессов и т. д.
Важно правильно решить вопрос о глубине изложения каждого раздела электронной теории: что и как должен учитель сообщить учащимся о строении атома, об электронной оболочке и структуре атомного ядра. Ведь глубокое понимание современного учения о строении атома возможно лишь на базе серьезного математического образования. Поэтому в обучение по данному разделу курса не следует вводить математических формул, определяющих состояние атома или молекулы. При ограничении круга знаний надо следить и за тем, чтобы у учащихся не сложились ошибочные представления.
При определении последовательности изложения этой темы важно выделить следующие моменты: 1) подготовка учащихся к усвоению электронной теории; 2) изложение основных положений теории; 3) применение теории для объяснения известных учащимся фактов и понятий; 4) приобретение новых знаний на основе теории.
При подготовке учащихся к усвоению электронной теории нужно иметь в виду, что в школьном курсе химии нельзя привести всего многообразия фактов, которые делают убедительными основные положения электронной теории. Однако некоторыми из них можно воспользоваться в качестве предпосылок к теории, начало изучению которой положено в курсе физики (радиоактивность, электрон). Из курса физики учащиеся знают о том, что атомы радия делимы, что существуют частицы значительно меньше атома. Для доказательства того, что электроны являются одной из структурных единиц атомов металлов, а не только атомов радия, можно показать учащимся явления, наблюдаемые в газоразрядных трубках. После этого надо ознакомить учащихся с современными представлениями о строении атомов, не касаясь пока структуры ядра, и составить вместе с ними схемы строения атомов элементов первых трех периодов. Затем необходимо изучить химические связи в молекулах или кристаллах различных веществ, а также рассмотреть, в свете этой теории валентность, окислительно-восстановительные реакции, радиоактивные превращения, некоторые искусственные ядерные реакции и периодическую систему.
Чтобы учащиеся лучше осознали значение открытия радиоактивности, следует во вводной беседе напомнить им о том, как установилось неправильное понятие о непревращаемости элементов друг в друга и понятие об атоме как о наименьшей неделимой частице. На этом фоне всеобщего признания неделимости атома открытие явления радиоактивного распада представляет особенно большой интерес.
Начать можно с краткого описания химических свойств радия, а затем перейти к явлению радиоактивности. При этом важно отметить: 1) из атома выбрасываются два вида материальных частиц (α и β-частицы); 2) излучаемые радием α-частицы равны по массе атомам гелия, но отличаются от последних наличием положительного электрического заряда; 3) в результате излучения образуются два элемента: гелий и радон, которые занимают определенные места в периодической системе; 4) масса атома радия равна сумме атомных масс радона и гелия. На этом основании делается заключение, что атом радия - сложная частица, продуктами распада которой являются атом гелия и атом радона.
При изучении радиоактивности, кроме спинтарископа, для учебных целей существуют школьные модели счетчика Гейгера - Мюллера. Наиболее удачной из них является демонстрационный индикатор ионизирующих излучений типа ИД-I При помощи этого прибора на уроках химии можно наблюдать проникающую способность β- и γ-лучей. Для этого используют циферблаты часов со светящимся радиоактивным составом или спинтарископ. Для показа малой проникающей способности аα-лучей ставят между циферблатом и счетчиком свинцовую пластинку. При этом сразу же резко сокращается регистрация числа ионизирующих частиц. Данный счетчик дает световые и звуковые сигналы.
При изучении строения атома наряду с описанными приборами следует использовать и другие средства наглядности, например диораму. Для этого на лицевой стороне листа тушью изображают схему, показанную на рисунке 54 сплошными линиями. На обратной стороне листа рисуют изображение конденсатора и схемы отклоняющихся в электрическом поле α- и β-лучей. α-лучи изображают красным жирным пунктиром, они отклоняются в сторону отрицательно заряженной пластины конденсатора и доходят до алюминиевого листочка, β-лучи изображают синим, менее широким пунктиром. Они сильно отклоняются в сторону положительно заряженной пластины конденсатора и доходят до алюминиевой пластинки. Все линии, подлежащие нанесению на обратной стороне листа, на рисунке отмечены пунктиром. Рисунок укрепляют на демонстрационном столе и в нужный момент за рисунком включают электрическую лампочку. Учащимся одновременно становится видно изображение как лицевой стороны таблицы, так и обратной, показывающей разложение лучей в электрическом поле на составляющие и проходимость через металлические перегородки отдельных видов излучений.
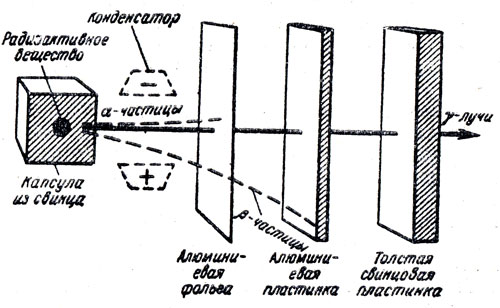
Рис. 54. Состав и свойства радиоактивных лучей
После изучения распада радия у учащихся естественно возникает вопрос: только атомы радия - сложные частицы или и другие атомы тоже состоят из частиц еще более мелких, чем сами атомы?
Чтобы доказать нахождение в атомах других элементарных частиц, сходных с теми, которые являются продуктами радиоактивного распада, следует объяснить явления в газоразрядных трубках (опыты не показывают, так как работа с трубками в школе запрещена). Необходимо обратить внимание учащихся на то, что свечение пластинки, помещенной в газоразрядной трубке, является результатом воздействия на пластинку частиц, имеющих отрицательный заряд. Доказательством служит отклонение "луча" в ту или иную сторону при поднесении к трубке магнита или электрически заряженного тела. Затем нужно рассказать, что эти частицы обладают массой, при воздействии которой на другие тела последним сообщается движение. Затем доказывается, что эти частицы имеют отрицательный электрический заряд. Учитель указывает, что частицы, образующие катодный луч, - те же β-частицы и называются они электронами. Следовательно, и атомы других элементов являются сложными. Наконец, можно сообщить, что раскаленный металл излучает электроны. Благодаря широкому развитию радиотехники многим учащимся известно устройство и принципы действия ламповых выпрямителей переменного электрического тока,
В настоящее время нельзя ограничиться понятием об электронах как об отрицательно заряженных частицах, которые движутся по строго фиксированной орбите. Надо дать понятие о двойственной природе электронов, т. е. как об отрицательных частицах, которые при распространении в пространстве ведут себя как волны. Характер движения электронов в атоме такой, что их орбиты не имеют точной траектории. Их орбиты представляют собой как бы размытое облако, вероятность нахождения электронов в атоме больше вблизи ядра и меньше в удалении от него. Здесь можно привести следующую аналогию. При стрельбе по мишеням у хорошего стрелка пули рассеяны вблизи "яблочка" и плотность их размещения уменьшается от центра к периферии мишени.
После этого нужно решить весьма важный вопрос: какие частицы, кроме электрона, входят в состав атомов металлов?
Для этого учитель может рассказать об опытах Резерфорда, на основании которых было установлено, что через тонкие металлические пластинки проходит лишь часть α-частиц, остальная же часть отражается под разными углами. Объясняется это тем, что в металлах находятся положительно заряженные частицы, которые отталкивают приближающиеся α-частицы, имеющие одноименные с ними положительные заряды. Обобщая этот вывод с предыдущим, учитель может сообщить, что электроны образуют внешнюю оболочку атома, а положительно заряженные частицы находятся в центральной части - в ядре атома. Доказательством такого расположения частиц может служить излучение электронов при накаливании металлов. Теперь же можно сообщить о сравнительных размерах электронов и атомных ядер. Таким образом учащиеся будут подготовлены к следующим обобщениям: атомы металлов - сложные частицы, они могут излучать электроны, масса которых почтив в 2000 раз меньше массы атома водорода; атомы содержат положительно заряженные ядра, объем которых меньше объема атома в несколько тысяч раз (имеют массу, почти равную массе всего атома).
Если атомы металлов являются сложными частицами, то нет основания считать атомы неметаллов неделимыми физическими телами. После того как установлено, что атом каждого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, нужно выяснить, как эти частицы располагаются в атоме, как связаны между собой и как все это связано со свойствами химического элемента. Возможны два пути приобретения учащимися этих знаний:
1) изучать сначала строение ядра, а затем расположение электронов в атоме;
2) ознакомиться сначала с внешней оболочкой атома, а затем изучить атомное ядро.
Сообщение учителя о количестве электронов в атоме, об их расположении может быть в какой-то мере доказательным, так как оно опирается на имеющиеся у учащихся знания о свойствах изученных ими элементов. Ознакомление же с составом ядра атома происходит догматически. По этим соображениям рекомендуется дальнейшее изложение электронной теории вести в такой последовательности: строение атомов элементов малых периодов, соединение атомов в молекулы, валентность, искусственная радиоактивность, протоны, периодическая система в свете строения атомов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'