
Азот
Так как учащиеся уже располагают некоторыми сведениями об азоте, вводную часть урока на эту тему следует начать с повторения. При этом может выявиться противоречивость знаний учащихся об азоте. На уроках химии они узнали, что азот не поддерживает жизни, а на уроках естествознания им сообщалось, что без азота нет жизни. Чтобы разрешить это кажущееся противоречие, нужно разъяснить учащимся, что в первом случае идет речь о простом веществе - азоте, а во втором случае - о сложных веществах, содержащих элемент азот.
Следует напомнить, что природные запасы свободного азота огромны и доступны человеку, и в то же время растения, культивируемые человеком, не всегда получают азотистое питание в должном количестве из-за недостатка в почве необходимых соединений азота. Отсюда возникает проблема превращения свободного азота, не поддерживающего жизни, в связанный азот, необходимый для жизни. А для этого нужно изучить свойства азота, условия его соединения с другими элементами. Чтобы показать учащимся свободный азот и" проделать с ним некоторые опыты, учитель получает его перед уроком и собирает в газометр.
Азот образуется взаимодействием нитрита натрия с хлоридом аммония.
Концентрированный раствор хлорида аммония (20 г NH4Cl в 55 мл воды) помещают в колбу, а в капельную воронку наливают раствор нитрита натрия (25 г NaNО2 в 35 мл воды), колбу подогревают, а затем спускают по каплям раствор нитрита натрия в горячий раствор хлорида аммония. Получающийся азот собирают в небольшой газометр.
В дополнение к знаниям о физических свойствах азота, полученным учащимися в VII классе, сообщается температура кипения азота и растворимость его в воде.
Перед изучением химических свойств азота следует вспомнить с учащимися его положение в периодической системе, схему строения его атома и на этом основании сделать ряд предположений о химических свойствах, а именно: о валентности азота в соединениях с водородом и с кислородом, об отношении его к водороду, к металлам, к кислороду. При изучении свойств азота рекомендуется проводить сравнение его свойств со свойствами кислорода и фтора. Сопоставляя условия соединения с водородом фтора и кислорода и сравнивая строение атомов этих элементов, учащиеся могут понять, что с уменьшением числа валентных электронов у атомов элементов, находящихся в конце второго ряда периодической системы, повышается химическая активность элементов в отношении к водороду. В подтверждение этого теоретического вывода следует сообщить, при каких условиях могут соединяться с водородом азот, фтор и кислород. Таким образом сравнивается химическая активность азота, кислорода и фтора (отношение их к водороду).
Анализируя уравнение реакции соединения азота с водородом, следует объяснить учащимся, что образованию молекул аммиака должно предшествовать разложение молекул азота и водорода на атомы. Так как молекулы азота стойки при обычных условиях, то азот сравнительно инертен при низкой температуре, но он может соединяться с кислородом при очень высокой температуре. Надо также сообщить учащимся о роли катализатора в этом процессе. Учитель отмечает относительность понятия о химической активности азота и зависимость ее от условий реакции.
Аммиак, его состав и свойства
При изучении этой темы необходимо: 1) рассказать о свойствах аммиака на базе ионной теории и дать сравнительную характеристику азота, кислорода, фтора; 2) сформировать понятие о радикале аммония.
Аммиак можно рассматривать в таком порядке: физические свойства, растворимость в воде, химические свойства, характер водного раствора, окисление аммиака, нахождение в природе, применение, получение. Для ознакомления учащихся, с физическими свойствами аммиака учитель может показать сосуд, наполненный газом, и дать его важнейшие физические константы. Что аммиак тяжелее водорода и легче воздуха, учащиеся узнают на основе закона Авогадро, сопоставляя молекулярную массу аммиака с водородом и средней молекулярной массой воздуха. Можно выставить на столы учащихся пробирки, наполненные аммиаком и закрытые каучуковыми пробками, и предложить учащимся осторожно понюхать этот газ. Учитель при этом проверит, умеют ли учащиеся нюхать неизвестный им газ. Следует также сообщить о легкой сжижаемости аммиака, хорошую растворимость аммиака в воде можно показать в том же приборе, каким пользовались при демонстрации растворимости хлористого водорода.
Важно отметить, что растворение аммиака является химическим взаимодействием аммиака с водой. Для этого демонстрируют опыт, из которого видно, что при растворении аммиака в воде образуется щелочь и этот процесс сопровождается выделением теплоты (рис. 77). Большем цилиндром с аммиаком накрывают пробирку, обернутую фильтровальной бумагой, смоченной раствором фенолфталеина. Пробирку соединяют с узкой стеклянной трубкой, заполненной подкрашенным раствором. При соприкосновении с аммиаком фильтровальная бумага приобретает малиновую окраску, а подкрашенная вода вследствие выделения теплоты под действием расширяющегося воздуха поднимается вверх, что хорошо видно по сравнению с первоначальным ее уровнем, отмеченным резиновым колечком. Так как учащиеся ознакомились с теорией электролитической диссоциации, то следует рассмотреть растворение аммиака в воде как взаимодействие полярных молекул аммиака и воды с образованием ионов аммония и гидроксила:
NH3+H2O=NH4++OH-
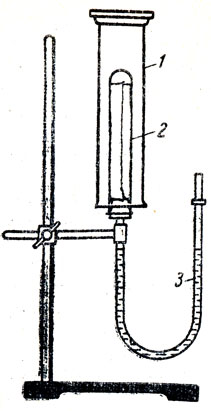
Рис. 77. Растворение аммиака: 1 - цилиндр с аммиаком, 2 - пробирка, покрытая фильтровальной бумагой, смоченной раствором фенолфталеина, 3 - трубка с подкрашенной водой
Присутствие гидроксильных ионов обнаруживают при помощи индикатора. Взаимодействие аммиака с водой следует рассматривать как обратимый процесс, направление которого зависит от температуры и концентрации раствора. Чтобы показать выделение аммиака при нагревании его раствора, можно проделать следующий опыт: в маленькой колбочке или в пробирке, закрытой пробкой с газоотводной трубкой, нагревают концентрированный раствор аммиака, собирают выделяющийся газ в пробирке и обнаруживают его по запаху или при помощи лакмусовой бумажки.
Для дальнейшего изучения свойств аммиака и иона аммония следует ознакомить учащихся с действием аммиака на кислоты. Можно получить хлористый аммоний соединением газообразного аммиака и хлористого водорода. Для этого рекомендуется набрать аммиак в сухой большой цилиндр, а хлористый водород - в другой такой же цилиндр. Затем цилиндр с аммиаком, перевернутый вверх дном, поставить на цилиндр с хлористым водородом и убрать стекла, закрывавшие их. Оба цилиндра наполняются белыми клубами хлористого аммония. Когда "дым" осядет на стенки и дно сосуда, этот осадок надо снять и сравнить с образцом хлористого аммония. Уравнение этой реакции следует записать так:
NH3+HCl=NH4Cl
Можно сравнить эту реакцию с рассмотренной ранее реакцией аммиака с водой. И в том и в другом случае молекулы аммиака присоединяют ион водорода. В результате этих реакций образуются ионы аммония и гидроксильные ионы или ионы аммония и хлор-ионы.
Сульфат и нитрат аммония получают, пропуская аммиак через кислоты, находящиеся в U-образных трубках, охлаждаемых водой. Уравнения этих реакций надо записать так, чтобы видно было образование иона аммония NH4+ путем присоединения к молекуле аммиака иона водорода:
NH3+H++NО3-= NH4+NО3-
Следует показать, что с кислотами взаимодействует не только свободный аммиак, но и его водные растворы. В три большие колбы наливают по 20 мл водного раствора аммиака. В каждую из них вставляют воронки для предосторожности, так как при взаимодействии аммиака с кислотами выделяется много теплоты. Затем во все колбы наливают по одной пробирке концентрированных кислот (соляную, серную, азотную). Там, где оказалась соляная кислота, слышится легкое шипение - выделяется хлористый аммоний; с азотной кислотой реакция идет более бурно: жидкость разбрызгивается, стенки колбы покрываются белым налетом нитрата аммония; в колбе с серной кислотой слышится треск, колба покрывается белыми кристаллами сульфата аммония.
Большое теоретическое и практическое значение имеют реакции окисления аммиака в чистом кислороде и в воздухе в присутствии катализатора при различных условиях. На рисунке 78 изображен прибор, которым можно воспользоваться для демонстрации горения аммиака в кислороде. Логическим продолжением урока об аммиаке является изучение солей аммония, с которыми учащиеся уже ознакомились при изучении свойств аммиака.
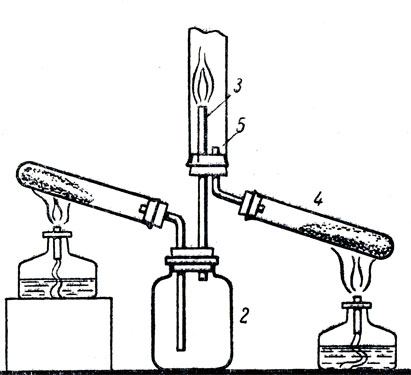
Рис. 78. Горение аммиака в кислороде: 1 - пробирка со смесью извести и хлорида аммония, 2 - сосуд для охлаждения водяного пара, 3 - трубка для выхода аммиака, 4 - пробирка с перманганатом калия, 5 - трубка, по которой поступает кислород
Соли аммония. Когда рассмотрены состав и свойства аммиака, появляется возможность разобрать состав и свойства солей аммония, научиться распознавать их, а также ознакомить учащихся с применением важнейших из них.
Для закрепления этих знаний следует сравнить несколько солей аммония с солями одновалентных металлов тех же кислот, обратить внимание на то, что в солях аммония в роли металла выступает группа атомов, имеющая один положительный заряд. При рассмотрении общих химических свойств солей аммония необходимо изучить характерные для них реакции обмена. С этой целью можно предложить учащимся проделать следующие опыты. В три пробирки, содержащие растворы хлорида аммония, сульфида аммония и нитрата аммония, приливают небольшие количества концентрированного раствора едкого натра, нагревают осторожно пробирки и по запаху обнаруживают выделение аммиака. Таким образом учащиеся знакомятся с одной из качественных реакций на ион аммония. Чтобы научить их обнаруживать и анионы этих солей, можно предложить проделать следующие опыты:
1. Подействовать раствором нитрата серебра на растворы хлорида натрия и хлорида аммония (реакция на хлор-ион).
2. Подействовать раствором хлорида бария на растворы сульфата натрия и сульфата аммония (реакция на сульфат-ион).
Выполнение описанных выше опытов и разбор уравнений реакций являются хорошими упражнениями в применении ионной теории при изучении реакций обмена. На этих примерах учащиеся вновь убеждаются в том, что обменные реакции, происходящие между солями в растворах, обусловлены взаимодействием ионов. Кроме того, они учатся распознавать соли аммония в растворах. Это умение имеет большое практическое значение для работников сельского хозяйства: таким способом можно обнаружить соли аммония в минеральных удобрениях.
Для закрепления приобретенных знаний и умений полезно предложить учащимся две-три экспериментальные задачи такого содержания:
1. Доказать, что данная соль есть соль аммония.
2. Найти среди других солей хлорид аммония.
3. Доказать, что данная соль есть сульфат аммония.
4. Доказать, что данная соль есть хлорид аммония.
При решении этих задач учащиеся одновременно упражняются и в составлении уравнений ионных реакций. Изучая с учащимися соли аммония, можно также ознакомить их с термической диссоциацией хлорида и карбоната аммония.
Опыт разложения хлорида аммония при нагревании можно продемонстрировать (рис. 79). В середине стеклянной трубки длиной 10-15 см делают пробку из асбестовой ваты (толщиной около 1,5 см). Для этого с одного конца трубки до ее середины вставляют деревянную палку, насыпают на нее асбестовую вату, а с другого конца утрамбовывают другой палочкой. Затем с одной стороны от полученной асбестовой пробки насыпают около 2 г нашатыря и трубку плотно закрывают резиновой пробкой. С другой стороны кладут влажную красную лакмусовую бумажку или фенолфталеиновую. Сначала нагревают часть трубки ближе к резиновой пробке (чтобы на ней не оседал нашатырь), а затем сильно нагревают нашатырь. При этом создается избыточное давление, и через пористую асбестовую пробку с различной скоростью пойдут аммиак и хлористый водород. Так как через эту перегородку быстрее диффундирует аммиак, то довольно быстро лакмусовая бумажка синеет (а фенолфталеиновая розовеет). После остывания трубки вынимают резиновую пробку и помещают синюю лакмусовую бумажку в ту часть трубки, где находился хлорид аммония (до соприкосновениях асбестом). Бумажка краснеет, так как хлористый водород задерживается со стороны асбестовой пробки.
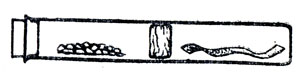
Рис. 79. Разделение аммиака и хлористого водорода при термической диссоциации хлорида аммония
Производство аммиака. Для понимания сущности химического производства, как известно, нужно рассмотреть и усвоить химические процессы, лежащие в его основе. Поэтому ознакомление с производством аммиака нужно начинать не с подготовительных процессов получения азотноводородной смеси, а с основного процесса - синтеза аммиака. Учащиеся сначала вспоминают опыт синтеза аммиака, рассматривают условия синтеза и разложения его и вспоминают о химическом равновесии.
При этом обращается особое внимание на смещение химического равновесия так, чтобы учащиеся сознательно могли ориентироваться в условиях прохождения реакций. Возникает вопрос: могут ли учащиеся средней школы без знания принципа Ле-Шателье осознать все эти сложные процессы? Этот принцип усваивается не всеми учащимися. Но возможно некоторое упрощение в объяснении его на основе атомно-молекулярных представлений.
О влиянии температуры на окисление сернистого газа учащиеся уже знают из темы "Сера". Поэтому учитель отмечает, что при синтезе аммиака наблюдается такая же закономерность > (более низкие температуры благоприятствуют выходу продукта). В случае равновесных систем, когда при химической реакции выделяется теплота, для большего выхода продукта необходимы невысокие температуры, так как при сильном нагревании происходит разложение продукта реакции и равновесие смещается в сторону получения исходных продуктов.
О влиянии давления на смещение химического равновесия можно судить по уравнению реакции:
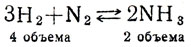
Известно, что при повышении давления или уменьшении объема увеличивается концентрация газов (возрастает число молекул в единице объема), поэтому при увеличении давления столкновения между молекулами будут более частыми. Очевидно, что частота этих столкновений между азотом и водородом начнет особенно усиливаться при увеличении давления (при одинаковом давлении в единице объема находятся 3 моля водорода и 1 моль азота, а аммиака только 2 моля). Увеличение давления положительно сказывается на смещении равновесия в сторону образования аммиака. Итак, в случае, если равновесные системы сопровождаются уменьшением объемов газов, то увеличение давления благоприятствует смещению химического равновесия в сторону образования газов с меньшим объемом. Для закрепления этого материала можно дать примеры: указать, в каких реакциях давление увеличивает выход продуктов (вещества взяты в газообразном состоянии):
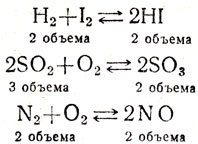
Разбирая эти уравнения реакций, учащиеся отмечают, что есть равновесные системы, где нет изменения объемов. Поэтому увеличение давления в одинаковой степени влияет как на скорость прямой, так и на скорость обратной реакции, т. е. давление не оказывает положительного влияния на выход продукта. При уменьшении объема давление содействует выходу продукта, если реакция идет с уменьшением объема (получение NH3).
Отмечается, что катализаторы одинаково влияют на скорость прямой и обратной реакции (они не влияют на смещение химического равновесия), но с применением катализатора быстрее наступит момент химического равновесия.
При изучении самого производства аммиака нужно вначале рассмотреть весь процесс по стадиям: а) подогрев сжатой азотноводородной смеси; б) прохождение ее над катализатором; в) охлаждение газовой смеси после синтеза аммиака; г) схема теплообмена и охлаждение колонны.
После этого можно рассмотреть схему устройства и действия колонны синтеза, используя таблицу с изображением этого аппарата.
При ознакомлении с условиями превращения азотноводородной смеси в аммиак нужно обратить особое внимание на огромные трудности, возникающие перед технологами. Ведь синтез аммиака выгоднее вести при высокой температуре, близкой к температуре размягчения стали, и при большом давлении. Можно отметить, что в этом случае на помощь химической промышленности пришла техника изготовления жаростойких сплавов - сталей, сохраняющих прочность при высокой температуре. Таким образом, будет выявлена взаимосвязь между различными производствами.
Прежде чем перейти к рассмотрению подготовки азотноводородной смеси для синтеза аммиака, необходимо сообщить учащимся, что катализатор, как и в сернокислотном производстве, действует лишь при условии, что в азотноводородной смеси нет таких примесей, как сероводород и сернистые соединения. Снижает действие катализатора и наличие в этой смеси кислорода, окиси углерода, водяных паров.
Из способов получения водорода можно остановиться на электролизе воды, отметив при этом, что проблема получения кислорода становится весьма актуальной, а при электролитическом способе получения водорода кислород является побочным продуктом. Так как учащиеся к этому времени ознакомились с теорией электролитической диссоциации, то представляется возможным рассмотреть схему электролитического разложения воды с использованием в качестве электролита едкого кали.
Следует рассмотреть получение водорода из водяного газа и отметить следующее:
1. При сжигании угля в смеси воздуха с водяным паром в газогенераторах может быть получена смесь газов, содержащая водород, азот, окись углерода и др.
2. Применяя различные способы очистки, можно получить для синтеза аммиака смесь только двух газов - азота и водорода.
3. Процесс получения этой смеси ведут так, что между количествами водорода и азота устанавливают отношение 3 моля водорода на 1 моль азота.
В порядке внеклассной работы можно предложить отдельным учащимся более подробно ознакомиться со способами получения азотноводородной смеси и составить соответствующие производственные схемы.
Окислы азота
В теме "Окислы азота" учащиеся узнают о веществах, которые имеют большое применение в промышленности; получают знания, которые помогают им составить более полную характеристику элементов пятой группы периодической системы, а также знакомятся с проявлением закона диалектики о переходе количественных изменений в качественные.
Из всех окислов азота практическое значение имеют три: окись, двуокись и азотистый ангидрид. Но желательно сравнить состав всех пяти окислов азота, это хорошо характеризует элемент азот и убедительно показывает, как вследствие изменения числа атомов одного и того же элемента в молекуле получаются качественно различные вещества. Поэтому можно рекомендовать сначала кратко ознакомить учащихся с составом всех окислов, обратить внимание на отношение между количествами кислорода, соединенного с одними и теми же весовыми частями азота, отметить закономерность в этих отношениях.
Полезно еще раз сравнить смеси и химические соединения, отметить скачкообразный характер в изменении их состава и свойств. После этого можно перейти к более детальному изучению окиси и двуокиси азота. Для ознакомления учащихся со свойствами окиси азота следует заранее заготовить некоторое количество этого газа, собрать его в газометр над водой.
На уроке учитель обращает внимание учащихся на то, что окись азота - бесцветный газ, практически нерастворимый в воде. Можно показать реакцию соединения окиси азота с кислородом. Для этого следует, не вынимая цилиндра из воды, впустить в него из другого газометра небольшое количество кислорода. Появление бурого газа укажет на окисление окиси азота до двуокиси. Вследствие хорошей растворимости двуокиси азота вода поднимется в цилиндре. При помощи индикатора легко обнаружить кислотные свойства этого раствора.
При изучении двуокиси азота следует уточнить и закрепить знания учащихся о химическом равновесии. Для этого следует на опыте решить наиболее сложный для них вопрос - смещение химического равновесия под действием давления. Этот опыт можно провести лабораторию в приборе (рис. 80). Пробирку закрывают поршнем из мягкой резины (удобно взять ученическую резинку), прикрепленным шурупом к деревянной ручке. Пробирку до урока заполняют двуокисью азота на 1/4 ее объема и закрывают поршнем с ручкой. На каждый стол выставляют по одному такому прибору. В начале опыта учащиеся рассматривают окраску двуокиси азота. Затем быстро (толчком) сжимают ее, продвигая поршень примерно на расстояние 2/3 длины пробирки. Вследствие уменьшения объема концентрация двуокиси азота увеличивается и она приобретает красно-бурую окраску, но через 1-2 сек окраска газа становится более светлой. Это объясняется тем, что часть двуокиси азота при комнатной температуре полимеризуется в бесцветный димер N2O4:
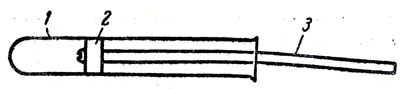
Рис. 80. Смещение химического равновесия под влиянием давления: 1 - пробирка с двуокисью азота, 2 - резиновый поршень, 3 - деревянная ручка
Двуокись азота NО2 и ее димер N2О4 находятся в состоянии химического равновесия. Так как этот процесс связан с уменьшением объемов, то давление благоприятно влияет на смещение равновесия в сторону образования бесцветного димера N2О4. При увеличении давления на 1 ат равновесие смещается на 50% в сторону увеличения концентрации димера. Но смещение наступает не мгновенно, а длится несколько секунд. Поэтому сначала за счет уменьшения объема увеличивается концентрация двуокиси азота, газ еще сильнее буреет, затем, когда увеличится концентрация димера, содержимое пробирки светлеет. Если быстро уменьшить давление, вынув поршень из пробирки (следить за тем, чтобы поршень находился у выхода пробирки!), то сначала газ светлеет (вследствие уменьшения концентрации газов), затем через 1-2 сек буреет, так как при уменьшении давления равновесие сдвигается в сторону образования бурой двуокиси азота. Этот опыт следует провести иллюстративно всему классу, так как учащиеся уже знают о влиянии давления на смещение химического равновесия. Проверка опыта в школе показала, что если учащимся не рассказать о том, что они должны наблюдать, то большинство из них не могут отметить изменений окраски газов, которые происходят под влиянием изменения давления.
Азотная кислота
Учебной задачей урока на тему "Азотная кислота" является повторение и приведение в систему приобретенных учащимися знаний об этой кислоте, а также более углубленное изучение окислительных свойств азотной кислоты и ознакомление учащихся с лабораторным способом ее получения.
При повторении учащиеся должны вспомнить о физическом состоянии, растворимости азотной кислоты в воде и о химических свойствах, общих для всех кислот, т. е. свойствах, обусловленных электролитической диссоциацией этой кислоты. К числу таких реакций относится взаимодействие азотной кислоты с основаниями. Большой интерес представляет знакомство учащихся с окислительными свойствами азотной кислоты. Эти свойства надо связать со строением атома азота и молекулы азотной кислоты.
Для демонстрации разложения азотной кислоты при нагревании можно воспользоваться прибором, изображенным на рисунке 81.
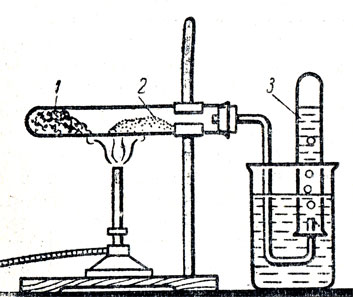
Рис. 81. Разложение азотной кислоты при нагревании: 1 - селитра, пропитанная концентрированной серной кислотой, 2 - сухой речной песок, 3 - кислород
В сухую пробирку насыпают калиевую или натриевую селитру и пипеткой приливают концентрированной серной кислоты с таким расчетом, чтобы селитра слегка смочилась и пробирку можно было закрепить горизонтально. Затем в эту же пробирку вблизи селитры насыпают слой сухого прокаленного речного песка. Пробирку закрывают пробкой с газоотводной трубкой, конец которой опускают в сосуд с водой. Учитель разбирает химизм получения азотной кислоты взаимодействием селитры с концентрированной серной кислотой. Отмечается, что азотная кислота - летучая жидкость, температура кипения ее 86° С. Пробирку обогревают, чтобы вытеснить из нее воздух. Затем сильно накаливают песок и время от времени пламя переносят на селитру (чтобы выделялись пары азотной кислоты). На конец газоотводной трубки опрокидывают пробирку с водой, в которой собирается кислород. После того как наберется полпробирки кислорода, его обнаруживают тлеющей лучинкой. На основании наблюдения опыта учащиеся могут сделать вывод о термической нестойкости молекул азотной кислоты и записать следующее уравнение реакции:
4HNО3=4NО2+О2+2H2О
Этот опыт и уравнение реакции позволяют сделать заключение о том, что азотная кислота является окислителем.
Перед изучением взаимодействия азотной кислоты с металлами и органическими веществами полезно вспомнить, как реагирует с теми же веществами серная кислота.
Можно также начать изучение окислительных свойств азотной кислоты с показа взаимодействия ее с углем. Для этого в азотную кислоту добавляют для удаления воды концентрированную серную кислоту. Смесь кислот нагревают в пробирке, затем дотрагиваются до поверхности нагретого раствора концом погашенной лучинки (тлеющий уголек). При этом он вспыхивает.
По аналогии с реакцией, происходящей между серной кислотой и медью, учащиеся разберутся и в реакции, происходящей между азотной кислотой и медью. При этом нет необходимости еще раз рассматривать взаимодействие разбавленной азотной кислоты с медью, так как это мало добавляет к характеристике азотной кислоты как окислителя, а излишне загружает память учащихся. Чтобы отметить "огнеопасность" азотной кислоты в известных условиях, можно показать эффектный опыт воспламенения скипидара при взаимодействии его с азотной кислотой.
Применение и производство азотной кислоты. Перед тем, как знакомить учащихся с применением азотной кислоты, следует напомнить им о генетической связи между элементом азотом, его окислом и гидроокисью и обратить особое внимание на то, что окись азота образуется из элементов с поглощением значительного количества энергии. Поэтому молекулу азотной кислоты можно рассматривать как аккумулятор химической энергии.
Это свойство передается и тем веществам, в состав которых входят кислотные остатки этой кислоты.
Отсюда можно сделать заключение, что азотная кислота должна найти применение в производстве таких веществ, которые обладают большим запасом химической энергии, способной переходить в другие виды энергии. Таким образом учащиеся будут подготовлены к пониманию, почему азотная кислота имеет и оборонное значение, и как средство для изготовления взрывчатых веществ, применяемых во взрывных работах в горнорудном деле и при гидросооружениях. Так как учащимся уже известны важнейшие соли азотной кислоты, применяемые в качестве минеральных удобрений, то достаточно напомнить им о них и объяснить, на чем основано применение азотной кислоты в туковой промышленности.
В порядке подготовки к изучению заводского способа получения азотной кислоты следует вспомнить о горении аммиака в кислороде, а затем показать опыт окисления аммиака в присутствии катализатора. Опыт можно провести в приборе, изображенном на рисунке 82. В пробирку с отводной трубкой наливают 25-процентный раствор аммиака (с раствором меньшей концентрации опыт не удается!). Так как смесь аммиака с кислородом может взорваться, то для предотвращения взрыва трубку заполняют битым стеклом. В качестве катализатора используют медную проволоку, которую засыпают свежеприготовленной окисью хрома, смешанного с асбестом.
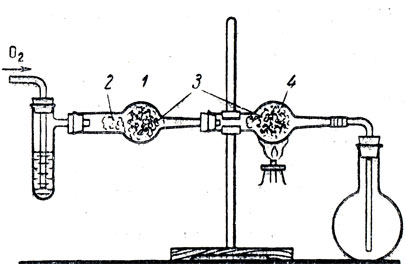
Рис. 82. Получение азотной кислоты из аммиака: 1 - трубка с битым стеклом, 2, 3 - тампоны из асбеста, 4 - катализатор
В начале опыта сильно нагревают катализатор. Затем из газометра начинают пропускать кислород через водный раствор аммиака. Смесь кислорода с аммиаком проходит над катализатором, который начинает раскаляться. В этот момент нагревание катализатора прекращают. Нельзя кислород пропускать слишком энергично, иначе катализатор раскаливается добела и трубка лопается. Колба быстро заполняется двуокисью азота. Иногда вначале появляется дымок, состоящий из нитрата и нитрита аммония, которые постепенно вытесняются двуокисью азота. Для прекращения опыта в колбу перестают подавать кислород. В колбу с двуокисью азота приливают немного воды и добавляют раствор лакмуса, который краснеет.
После разбора этого опыта учитель переходит к рассмотрению процесса окисления аммиака на платиновой сетке в конверторе. Сначала рассматривается схема аппарата, указываются условия полного окисления аммиака, отмечается экзотермичность этого процесса, называются продукты реакции и состав газовой смеси, уходящей из конвертора. Затем следует рассмотреть условия окисления окиси азота в двуокись и ее гидратацию. При этом важно указать на: а) необходимость охлаждения газовой смеси; б) осуществление принципа противотока при поглощении окислов азота водой; в) необходимость применения кислотоупорных материалов для устройства поглотительных башен. При изучении гидратации двуокиси азота учащиеся с большим трудом воспринимают этот процесс, так как учитель не показывает им того, что здесь, помимо азотной кислоты, образуется окись азота. Это можно продемонстрировать следующим способом. Большой стеклянный цилиндр до урока заполняют двуокисью азота (вытеснением воздуха). Цилиндр закрывают резиновой пробкой. В начале демонстрации вынимают пробку и в цилиндр при помощи пипетки вливают воду (конец пипетки опускают на дно цилиндра). Для опыта берут 3-4 мл воды на каждые 100 мл объема цилиндра. Цилиндр снова закрывают пробкой и сильно встряхивают. Вследствие образования азотной кислоты и бесцветной окиси азота окраска двуокиси азота исчезает. Открывают цилиндр и сразу же в верхней части его появляется бурая окраска двуокиси азота, так как окись азота окислилась кислородом воздуха. Бурая окраска двуокиси азота постепенно распространяется по всему цилиндру. Нужно также показать использование теплоты выходящих из конвертора газов для нагрева воды в паровых котлах; следует рассмотреть схему производства азотной кислоты; конвертор, паровой котел, систему поглотительных башен и резервуары для приема готовой продукции.
В заключение следует сказать, что в дореволюционной России не было своей азотной промышленности. Азотную кислоту получали из привозной селитры (чилийской или норвежской) действием на нее серной кислоты, что почти единственным поставщиком селитры для всех стран являлась в то время одна страна - Чили.
Чтобы еще более усилить внимание учащихся к проблеме синтеза азотной кислоты, следует рассказать об опасности "азотного голода" для всего мира. Таким образом, учащиеся знакомятся с возникновением проблемы связанного азота, которая имеет огромное значение для всех стран. После этого можно сообщить, как эта проблема разрешалась на протяжении последнего полувека.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'