
Коррозия металлов
В вводной беседе на занятиях по этой теме следует разъяснить учащимся, что для нашей индустриальной страны, изготовляющей огромное количество машин и металлических конструкций, имеет большое значение рационально организованная борьба с потерями металла, с коррозией. А для этого необходимо изучить процессы коррозии. Подготовка учащихся по химии к этому времени позволяет познакомить их с основами учения о коррозии, разобрать и теоретически обосновать важнейшие мероприятия по борьбе с нею. Можно предложить следующий план изучения этой темы:
1. Общая характеристика различных видов коррозии.
2. Коррозия металлов, находящихся в жидкой среде.
3. Предохранение металлов от коррозии.
Коррозией можно назвать разрушение металлов и сплавов вследствие химического воздействия на них внешней среды. Следует отметить, что это разрушение происходит с поверхности и сопровождается часто изменениями внешнего вида металла. Рассматривая взаимодействие металлов с окружающей их средой, нужно указать на следующие виды коррозии: а) взаимодействие металла с газами (газовая коррозия); б) коррозия металлов во влажной среде. Из газовой коррозии можно отметить взаимодействие металлов с кислородом при высокой температуре, разрушение дымогарных труб, химической аппаратуры от действия хлора, серного ангидрида, окислов азота, хлористого водорода и т. д. Химические реакции, происходящие при этом, известны учащимся.
Коррозия металлов в жидкой среде. Простейшим примером такого вида коррозии является взаимодействие металла с водой или с кислотой, происходящее с выделением водорода. При разборе этих реакций необходимо напомнить учащимся о структуре металлов и сообщить, что в раствор переходят только ионы металла, а электроны остаются на поверхности растворяющегося металла. Поэтому образуются два противоположно заряженных слоя: раствора и металла (рис. 90). Ионы водорода, которые всегда находятся в воде, приблизившись к металлу, могут присоединять электроны. Таким образом происходит восстановление ионов водорода в атомы и в молекулы (водород выделяется из раствора). Точно так же можно рассмотреть взаимодействие цинка с водой, а затем и с соляной кислотой. Ионы металла переходят в раствор кислоты с большей скоростью, чем в воду. Это следует объяснить увеличением концентрации водородных ионов в растворе за счет диссоциации кислоты.
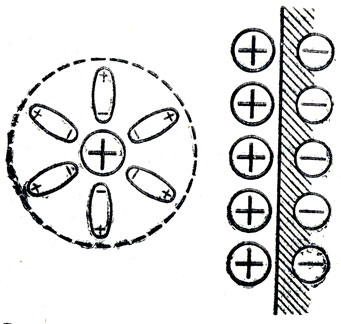
Рис. 90. Схема перехода ионов металла в раствор
Можно рассмотреть взаимодействие с растворами кислот и других металлов, которые стоят в электрохимическом ряду металлов левее водорода. Как убедиться в том, что на поверхности реагирующего металла действительно появляются избыточные электроны в результате перехода ионов металлов в раствор? Решению этого вопроса поможет демонстрация опыта (рис. 91). В стакан с разбавленной серной кислотой (10-процентной) опускают узкую длинную трубку, нижний конец которой расширен. На верхний, узкий конец трубки надевают каучуковую трубку с зажимом. В нижнюю, расширенную часть вводят медную пластинку или спираль, к которой прикрепляют медный провод, выходящий за край стакана. Перед началом опыта засасывают в стеклянную трубку при помощи пипетки кислоту и обращают внимание учащихся на то, что медь не реагирует с кислотой.
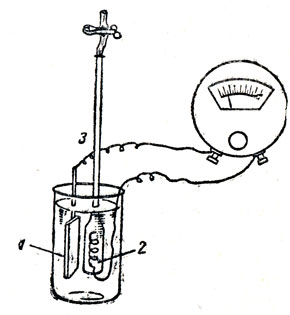
Рис. 91. Схема простейшего гальванического элемента: 1 - цинковая пластинка, 2 - медная спираль, 3 - стеклянная трубка с раствором серной кислоты
После этого к медной спирали или пластинке, находящейся в трубке, присоединяют проводом цинковую пластинку и опускают ее в стакан с кислотой рядом со стеклянной трубкой. Тогда с поверхности меди начнут отделяться пузырьки водорода и собираться в верхней части трубки. Если в цепь включить гальванометр, то он покажет электрический ток в цепи. Это явление следует объяснить так: медь практически не взаимодействует с разбавленной серной кислотой, поэтому в раствор не переходят ионы металла из медной пластинки и на поверхности ее отсутствуют избыточные электроны. На цинковой же пластинке остаются электроны вследствие того, что ионы цинка переходят в раствор. Как только соединят обе пластинки проводником электрического тока, электроны станут перемещаться с цинковой пластинки на медную. Это движение электронов обнаруживает гальванометр. Перемещение электронов прекратилось бы, как только концентрация их на цинковой и медной пластинках стала бы одинаковой. Но медная пластинка погружена в раствор, содержащий ионы водорода, которые, соприкасаясь с поверхностью меди, снимают электроны, перешедшие на нее с пластинки цинка. Вследствие этого на медной пластинке оказывается опять меньше электронов, чем на цинковой, и поток электронов от цинка к меди продолжается. Эти реакции можно обозначить следующими уравнениями:
Zn=Zn2++2e-
Ионы цинка переходят в раствор, электроны, оставшиеся на поверхности цинка, движутся по проводнику к медной пластинке, где происходит соединение иона водорода с электроном:
2H++2e-=2Н
Образовавшиеся атомы водорода соединяются в молекулы. При демонстрации этого опыта нужно отметить, в какую сторону отклоняется стрелка гальванометра и к каким клеммам этого прибора присоединены провода. Это поможет учащимся лучше разобраться в опытах, которые рекомендуется показать для ознакомления с действием гальванических пар металлов. Для выполнения этих опытов можно воспользоваться прибором, изображенным на рисунке 92. В U-образную трубку наливают раствор хлорида натрия и опускают две металлические проволочки или стерженьки из разных металлов. Электрические провода, прикрепленные к этим проволочкам, присоединяют к клеммам гальванометра. По отклонению стрелки в ту или другую сторону судят о том, в каком направлении перемещаются электроны, какой из металлов данной пары посылает в раствор больше ионов и на поверхности какого металла собирается больше электронов. Если к раствору соли добавить несколько капель фенолфталеина, то можно наблюдать появление малиновой окраски в том колене, в которое погружен менее активный металл.
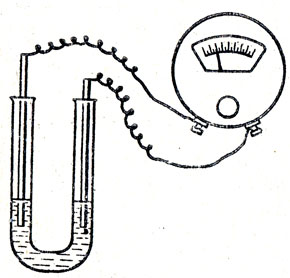
Рис. 92. Пара металлов в растворе соли
На этом опыте учащиеся увидят отдельно две стороны процесса: переход в раствор металла (магния или цинка в одном колене трубки) и выделение водорода (на меди в другом колене трубки). Если изучалась пара медь - магний, то уравнение этих реакций можно записать так:
На аноде (на пластинке магния):
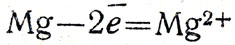
На катоде (на пластинке меди):
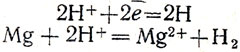
Итоговое уравнение:
Так как ионы водорода в растворе образовались вследствие диссоциации воды на ионы водорода и гидроксильные ионы, то с уходом из раствора водородных ионов в избытке оказываются гидроксильные ионы. Этим объясняется щелочная реакция раствора около менее активного металла (меди).
Анализируя этот процесс, учитель обращает внимание учащихся на то, что удаление электронов с пластинки цинка способствует ускорению перехода в раствор ионов этого металла, так как они не удерживаются у поверхности металла избыточными электронами, свободно диффундируют в растворе, уступая место ионам, уходящим из металла. Таким образом, при контакте двух металлов, находящихся в активной среде, скорость коррозии более активного из них повышается. Для иллюстрации этого можно предложить учащимся проделать такой опыт: в одну пробирку с разбавленной серной кислотой опустить кусочек чистого цинка, в другую - цинк в контакте с медной проволочкой и наблюдать по выделению водорода, в какой пробирке реакция идет более интенсивно.
Затем следует показать действие гальванических пар, в которых магний, цинк, алюминий находятся в контакте с углем или графитом. Для этого достаточно заменить медную пластинку угольком из гальванического элемента для карманного электрического фонаря или графитом из карандаша. Гальванометр, включенный в цепь, обнаружит электрический ток.
Теперь можно перейти к формированию понятия о микроэлементе и коррозии неоднородного сплава. С этой целью следует предложить учащимся проделать такой опыт: в две пробирки с разбавленной серной кислотой опустить кусочки цинка одинаковой величины, отличающиеся тем, что один совершенно чистый, а другой обработан медным купоросом и в некоторых местах покрыт медью. Этот кусочек цинка следует рассматривать как комбинацию маленьких гальванических элементов. Из сравнения скоростей растворения чистого и загрязненного металла (о чем можно судить по количеству выделяющегося водорода) учащиеся делают вывод о том, что однородный металл больше сопротивляется коррозии, чем неоднородный.
Так как учащиеся ознакомились с различными видами сплавов, то они должны понять значение и вместе с тем трудности изготовления однородного сплава. Можно сказать, что металл, кажущийся чистым, может быть с поверхности загрязнен сажей, пылью, состоящей из окислов, более стойких в отношении к воде, чем металлы, вследствие этого на чистом металле образуются гальванические микропары, служащие причиной ускорения коррозии металлов.
В результате такой беседы учащиеся должны прийти к следующим выводам:
1. Коррозия металла в растворе электролита является электрохимическим процессом.
2. Коррозия ускоряется в случаях: а) контакта металлов различной активности, б) неоднородности сплава, в) загрязнения поверхности металла.
Роль кислорода в процессе коррозии металлов. Какую роль играет кислород в коррозийных процессах? Всем хорошо известно его участие в ржавлении железа и окислении других металлов. Чтобы уяснить роль кислорода в процессе коррозии металлов, нужно рассмотреть процессы поляризации и деполяризации в простейшем гальваническом элементе. Можно снова показать действие гальванической пары цинк - медь в растворе хлорида натрия. При этом нужно заметить, что в начале процесса стрелка гальванометра отклоняется сильно, а затем постепенно приближается к нулевому делению, показывая уменьшение силы тока и замедление процесса коррозии цинка. Объяснив кратко причины замедления этой реакции (накопление водорода у катода), учитель сообщает, как устраняется поляризация.
В качестве деполяризатора можно применять перекись водорода, раствор которой приливают в катодное пространство (в то колено трубки, в которую погружена медная пластинка или медная проволочка). Гальванометр тотчас покажет усиление тока, т. е. ускорение процесса перехода цинка в раствор. Следовательно, кислород, находящийся в растворе электролита, ускоряет процесс коррозии тем, что окисляет водород у катода, т. е. является деполяризатором.
Важно рассмотреть процесс коррозии в случае неравномерного доступа кислорода к металлу. Для этого можно проделать следующий опыт: две цинковые или железные проволочки или пластинки, соединенные с гальванометром, опускают в U-образную трубку с раствором хлорида натрия (рис. 93), а затем в одно из колен пускают равномерно ток кислорода, омывая им металл.
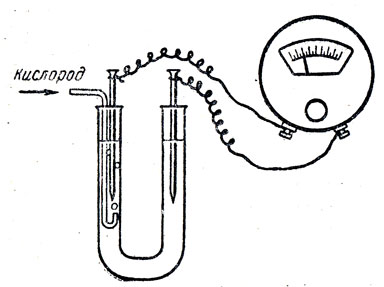
Рис. 93. Коррозия металлов при неравномерной аэрации
Небольшое, но заметное отклонение стрелки гальванометра покажет электрический ток во внешней цепи. Объяснить это явление можно образованием на окисляемом металле защитной окисной пленки, благодаря которой этот металл становится более стойким (менее активным, чем второй, не омываемый кислородом). Если учителю не представляется возможным показать этот опыт, нужно рассказать о нем, так как разбор этой реакции поможет учащимся лучше понять процесс ржавления железа. После этого следует приступить к рассмотрению коррозии, которая происходит на поверхности железа, покрытого раствором соли. Для этого на хорошо очищенные от ржавчины железные пластинки наливают горячий раствор, содержащий 1,5% желатина, 3% хлорида натрия, несколько капель раствора фенолфталеина. Затем пластинки с налитым на них раствором помещают в эксикатор, на дне которого находится вода, и оставляют до следующего дня. На уроке учитель демонстрирует застывшие "капли" раствора на пластинках и обращает внимание учащихся на появление малинового цвета кольца по окружности и кольца бурого цвета, отделяющего центральную часть от внешнего кольца. Перед объяснением этого явления учитель напоминает об опыте, из которого учащиеся сделали вывод о коррозии железа при неравномерном окислении его кислородом.
Переходя затем к изучению процессов, происходящих в капле раствора соли и в каплях на железе, учитель, пользуясь рисунком 94, разъясняет, что в наружных частях капли растворено больше кислорода, чем внутри капли. Участки железа, находящиеся ближе к наружной части капли, лучше омываются кислородом, на них появляется тонкая окисная пленка. Эта часть металла становится катодом. Здесь ионы водорода, присоединив электроны, становятся атомами, а оставшиеся избыточными гидроксильные ионы обусловливают щелочную реакцию (малиновая окраска фенолфталеина)*.
* (Если к раствору электролита добавить раствор кровяной соли, то в центре капли на железной пластинке будет видно синее пятно, показывающее, что в этом месте поступают на пластинки в раствор ионы железа.)
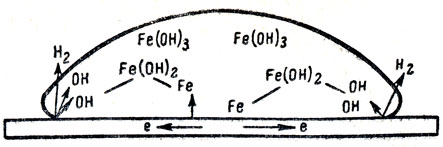
Рис. 94. Коррозия железа в растворе хлорида натрия
В центре капли соли меньше кислорода, поэтому ионы железа легко переходят в раствор. Они диффундируют в растворе от центра к периферии, а гидроксильные ионы движутся в обратном направлении. В месте их встречи образуется нерастворимая гидроокись железа (II) Fe(OH)2, которая при взаимодействии с кислородом в присутствии влаги переходит в бурый осадок гидроокиси железа (III) Fe(ОН)3 (бурое кольцо). Кроме того, на открытом воздухе в этом процессе принимает участие и углекислый газ, образуя с ионами железа нерастворимый карбонат. После такого углубленного ознакомления учащихся с процессами, происходящими при ржавлении, им станет понятным, почему ржавчина накопляется прежде всего в углублениях, куда затруднен доступ воздуха, а места, хорошо омываемые кислородом воздуха, остаются светлыми, не пораженными коррозией.
Для закрепления полученных знаний можно предложить учащимся вопросы:
1. В пробирке с раствором хлорида натрия с добавкой фенолфталеина опущены проволочки медная и алюминиевая (отдельно). Объяснить, почему около медной проволочки появилось розовое кольцо, а около алюминиевой его нет. Почему это кольцо появилось сверху, а не снизу и не в середине?
2. Чистый железный гвоздь опущен в пробирку с разбавленным раствором соляной кислоты. Почему от верхней части гвоздя отделяется больше пузырьков газа, чем от нижней?
Борьба с коррозией. Перед беседой на эту тему необходимо кратко повторить основные виды и условия протекания коррозии. Прежде всего следует отметить:
1) неоднородность металла, которая приводит к образованию гальванических пар;
2) наличие электролита, без которого невозможен гальванический элемент;
3) действие кислорода как деполяризатора и как окислителя, способствующего в случае неравномерной аэрации (соприкосновение с воздухом) образованию гальванической пары - окисленного и неокисленного металла;
4) действие других веществ, ускоряющих коррозию, - углекислого газа, сероводорода, сернистого газа и т. д.
После этого можно рассмотреть меры борьбы с коррозией:
1. Изготовление изделий из однородного металла.
2. Предохранение изделий от пыли, так как кусочки угля, окислов и других веществ могут послужить причиной образования гальванических микроэлементов на поверхности металла.
3. Предохранение металла от влаги, чтобы на поверхности его не было раствора электролита.
4. Устранение путем механической обработки шероховатостей, заусенцев и зазубрин на поверхности металла (во избежание неравномерной аэрации).
Большое практическое значение имеет покрытие металла слоем вещества, химически стойкого к атмосферному воздействию. Особенно интересно ознакомить учащихся с металлическими покрытиями. Не вдаваясь в подробности описания различных способов металлизации, можно ознакомить учащихся лишь с химическими основами некоторых из них. Наиболее простой способ покрытия одного металла другим основан на реакции замещения одного металла другим в растворе соли. Примером этого способа является омеднение проволоки - погружение ее в ванну с медным купоросом. Существенным недостатком этого способа является малая прочность связи покрытия с поверхностью покрываемого металла. Эти недостатки устраняются при гальваническом покрытии. Сущность этого метода состоит в том, что покрываемый металл погружается в раствор соли, содержащий тот металл, которым нужно покрыть, а затем производят электролиз. Покрываемый металл служит одним из электродов. В качестве призера такого покрытия можно показать опыт никелирования или омеднения какого-либо предмета. Толщина слоя покрытия зависит от длительности электролиза. Большим достоинством этого метода является сравнительная прочность и равномерность покрытия, легкая управляемость процессом.
Необходимо также разъяснить значение покрытий металлами различной активности, например цинкование и никелирование железа. В первом случае покрывающий слой не обладает красивым блеском и большой прочностью. Но в случае местных повреждений его железо не будет корродировать, так как в паре железо - цинк железо должно быть катодом, потому что оно менее активно. В случае нарушения цинкового покрытия цинк продолжает играть роль предохранителя (протектората) железа от коррозии. В случае местных повреждений никелевого слоя (никель менее активен, чем железо) в гальванической паре он является катодом, а железо - анодом. Тем самым никелевое покрытие стимулирует ржавление тех участков железа, с которых почему-либо снято никелевое покрытие. Поэтому избегают никелировать предметы, работающие в условиях влажности и возможных повреждений поверхности металла. Когда нет необходимости добиваться блеска покрываемого изделия, например, ведра, то железо покрывают цинком. Нужно рассказать учащимся и о горячем покрытии металлами (лужении, цинковании), а также покрытии или погружением изделия в расплавленный металл, или распылением расплавленного металла по поверхности покрываемого изделия.
В заключение следует познакомить учащихся с покрытием слоем неорганических или органических веществ (неметаллическим). Можно рассмотреть хотя бы оксидирование и окраску металлов.
Для ознакомления с воронением железа можно приготовить концентрированный раствор смеси селитры и едкого натра (650 г NaOH, 250 г KNО3 на 1 л воды), погрузить в него хорошо очищенный железный гвоздь или пластинку и нагревать в течение 1-2 ч при температуре примерно 140°С. Противокоррозийную устойчивость покрытого железа можно показать, составив гальваническую пару: чистое и вороненое железо.
Из покрытий прежде всего следует рассмотреть окраску и лакирование. Ведущую роль в этих покрытиях играет олифа и другие масла, при окислении и высыхании которых образуется эластичная устойчивая пленка. Добавление красок усиливает прочность и долговечность покрытия. Нужно лишь учитывать, что и эти добавки к олифе могут сами по себе замедлять или усиливать коррозию в случае повреждения слоя покраски. К числу первых относится цинковая пыль, алюминиевый порошок, ко вторым - сажа, графит и некоторые окислы металлов.
Весьма важную роль в предохранении металлов от коррозии играют некоторые вещества, замедляющие коррозийные процессы. Эти вещества называются ингибиторами. К сожалению, теория этого процесса еще не разработана настолько, чтобы можно было излагать ее доступно. Но некоторые опыты, характеризующие действие ингибиторов, надо показать учащимся.
В три стакана наливают разбавленную (в три раза) соляную кислоту. Затем в один стакан добавляют пять таблеток уротропина, предварительно измельчив их, в другой - 50 мл 40-процентного раствора формалина, а в третьем стакане остается кислота без добавок ингибитора. Помещают в три пробирки по одинаковому железному гвоздику и вливают в них кислоты: в одну - из первого стакана, в другую - из второго, в третью - из третьего. Пробирки с кислотами опрокидывают вверх дном, погружают в соответствующие стаканы с кислотой и оставляют на некоторое время. Скоро обнаруживается, что пробирка с чистой кислотой быстро наполняется водородом. В других пробирках едва можно обнаружить появление пузырьков газа на поверхности железа.
Отмечая важность всех мероприятий по защите металлов от коррозии, следует обратить внимание учащихся на значение бережного отношения к металлическим изделиям.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'