
3. Атомные и молекулярные веса
Согласно атомной теории атомы отдельных элементов отличаются друг от друга весом. Самым легким является атом водорода, который, как установили современные физические опыты, весит 1,62 * 10-24г.* Эту величину, бесконечно малую, называют абсолютным атомным весом водорода; но так как такие незначительные числа трудно поддаются счету, то были заведены относительные атомные веса, которые называются атомными весами элементов. Это отвлеченные числа, указывающие во сколько раз атом какого-нибудь элемента тяжелее атома водорода, принятого за основу равную единице (Н = 1). Тогда атомный вес кислорода будет О = 15,88. Позднее, когда выяснилось, что кислород, соединяясь с другими элементами, дает гораздо больше соединений, чем водород, за основу атомных весов был взят атомный вес кислорода О = 16,000. В таком случае атомный вес водорода выразится величиной несколько больше единицы, а именно 1,008.
*(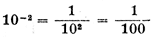 так что 10-24 является дробью, знаменатель которой равен единице с 24-мя нулями.)
так что 10-24 является дробью, знаменатель которой равен единице с 24-мя нулями.)
Атомные веса элементов или их кратные указывают основные соотношения, в которых элементы взаимно соединяются. Они указаны в таблице элементов рядом с другими величинами, значение которых будет объяснено позднее.
Величины атомных весов устанавливались постепенно экспериментальным путем, т. е. на основании неоднократно повторенных химических анализов различнейших соединений; они постоянно контролируются Международной Унией и их новейшие значения ежегодно публикуются в специальных журналах.
Действительные веса молекул весьма незначительны, а поэтому - так же как у элементов - они измеряются относительными молекулярными весами. У газообразных элементов молекулярный вес равняется двойному весу атома. У соединений молекулярный вес вычисляется путем сложения атомных весов всех элементов, из которых состоит соединение. Так напр. молекулярный вес кислорода О2 = 2 * 16 = 32, азота N2 = 2 * 14,008 = 28,016, водорода Н2 = 2,016 и т. д.. Молекулярный вес FeS = 55,85 + 32,066 = 87,916, молекулярный вес РbО = 207,21 + 16 = 223,21 и т. д.
Если мы выразим атомный вес элементов в граммах, то получим величину, называемую грамм-атомом. Напр. 1,008 г водорода является грамм-атомом водорода, 35,457 г хлора - грамм-атомом хлора, 16 г кислорода - грамм-атомом кислорода и т. д. Молекулярный вес элементов или соединений, выраженный в граммах, называется грамм-молекулой или молем. Напр. грамм-молекула (моль) хлора = 2 * 35,457 = 70,914 г хлора, кислорода = 2 * 16 = 32 г кислорода, моль Н2О = 2 * 1,008 + 16 = 18,016 г и т. д.
Названия "грамм-молекула", "моль" а также "молекула" употребляются и у ионных соединений, не образующих молекул. Напр. моль NaCl - 22,997 + 35,457 = 58,454 г NaCl.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'