
8. Атомная теория и валентность
Взаимное соединение элементов не является произвольным; опыт показал, что только некоторые элементы соединяются с другими (образуют с ними соединения), некоторые же элементы с другими вообще не соединяются. Атомная теория предполагает, что каждый атом является центром химической соединяемости (химического сродства), которая у разных элементов или одинакова, или различна, т. е. каждый атом одного элемента способен соединяться с одним или несколькими атомами другого элемента.
Если два элемента эквивалентны, т. е. их соединяемостъ одинакова, то они соединяются в простых весовых отношениях, т. е. один атом одного элемента с одним атомом другого элемента. Так это происходит в соединениях, которые мы для простоты приводим в стехиометрических расчетах, как напр. HCl, РbО, HgO, ZnS и т. д. В действительности же этим способом соединяются только немногие элементы, потому что, как правило, элементы имеют разную валентность (разную соединяемость), в результате чего соединяются в кратных отношениях, т. е. один или несколько атомов с несколькими атомами другого элемента.
Эта способность атомов связывать один или большее число атомов другого элемента - называется валентностью. Единицей (мерой) валентности является соединяемость водорода, т. к. было установлено, что только один атом водорода соединяется только с одним атомом другого элемента. Следовательно, водород одновалентен. Одновалентным является каждый элемент, который соединяется с водородом в простых весовых отношениях. Любой другой элемент будет многовалентным (двухвалентным, трехвалентным и т. д.), а именно столько валентным, со сколькими атомами водорода его атом соединяется (или сколько атомов водорода он может заменить).
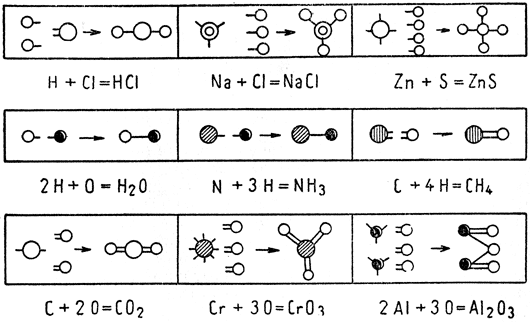
Рис. 6. Схематическое изображение возникновения эмпирических формул
Валентность, как правило, обозначается римскими цифрами, так что мы пишем: одновалентный водород HI, двухвалентный кислород ОII, трехвалентный азот NIII, четырехвалентный углерод CIV, пятивалентный фосфор PV, шестивалентный хром CrVI, семивалентный марганец MnVII и восьмивалентный осмий OsVIII (наиболее высокая известная нам валентность).
Согласно атомной теории реакция соединения элементов объяснялась как связывание отдельных атомов единицами валентности, как это изображено на рис. 6.
От этих наглядных представлений оставался только один шаг к так наз. структурным формулам, намечающим структуру молекулы (ее строение или размещение атомов в молекуле):
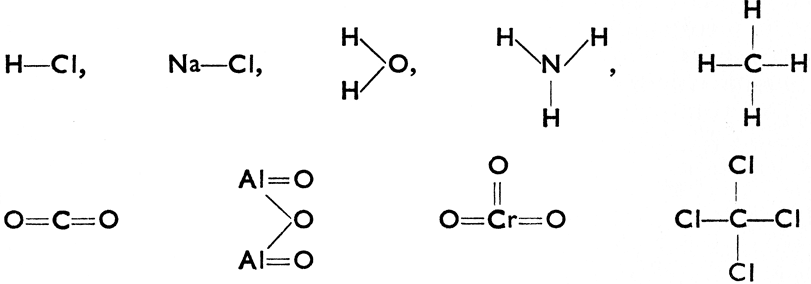
Структурные формулы сохранили значение только для некоторых соединений, в частности органических. У большинства неорганических соединений оказалось, что только соединение единиц валентности в так наз. знак валентности не дает правильной картины о действительных отношениях между отдельными атомами. Как пример приведём соединение NaCl (хлористый натрий) и ССl4 (четыреххлористый углерод), структурные формулы которых приведены выше. Хлористый натрий - это вещество кристаллическое с высокой точкой плавления, растворимое в воде, проводящее электрический ток, так как NaCl в водном растворе расщепляется на различно заряженные частицы Na+ и Cl-. Четыреххлористый углерод - это жидкость с точкой кипения 78°С, в воде нерастворимая и непроводящая электрический ток. Из этого видно, что характер связи между Na и Cl и связи между С и Cl не может быть одинаковым. Иными словами знаками валентности можно пользоваться лишь в определенных случаях.
Несмотря на то, что понятие валентности противоречит некоторым новым открытиям современной физики, все же валентность сохранила значение главным образом потому, что на валентности основаны выводы эмпирических формул соединений и химическая номенклатура.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'