
5. Твердые вещества
Твердые вещества имеют определенный объем и форму. Их частицы не движутся произвольно, т. к. каждая частица совершает колебательное движение только вокруг своего равновесного положения. С увеличением температуры кинетическая энергия увеличивается настолько, что сплоченность частиц нарушается и твердое вещество превращается в жидкость, которую называем сплавом. При постепенном охлаждении сплава вещество твердеет. У некоторых веществ сплав в определенный момент настолько мало вязок, что частицы вещества приобретают возможность определенным способом сгруппироваться в так наз. кристаллическую решетку. Такие вещества называются кристаллическими (твердые вещества природные). У некоторых веществ вязкость сплава достигает такой величины, что их частицы не образуют правильных формаций, а затвердевают с образованием бесформенных или аморфных веществ (твердые вещества искусственные), как напр. стекло, смола и асфальт. Аморфные вещества составляют переход от жидкостей к твердым веществам. Мы принимаем их за жидкости с почти нулевой текучестью (текучесть = противоположность вязкости).
Большинство твердых веществ - вещества кристаллические. Они выделяются из растворов в виде правильных геометрических формаций, кристаллов. Наблюдением за кристаллами и изучением их структуры (внутреннего строения) занимается кристаллография.
На основе симметричности кристаллов, кристаллография делит их на шесть кристаллографических систем:
1. кубическая; отличительный признак: три взаимно-перпендикулярных оси (параметры) одинаковой длины;
2. квадратная (тетрагональная); отличительный признак: три взаимно-перпендикулярных оси; две из них одинаковой длины, а третья (вертикальная) длиннее;
3. ромбическая; отличительный признак: три взаимно-перпендикулярных оси различной длины;
4. моноклиническая; отличительный признак: три оси разной длины; две оси взаимно-перпендикулярны, а третья наклонная;
5. триклиническая; отличительный признак: три оси разной длины, расположенные под разными углами друг к другу;
6. гексагональная, которая отличается четырьмя осями; три из них, одинаковой длины, лежат в одной плоскости и образуют угол в 60°, четвертая ось длиннее и перпендикулярна к их плоскости.
Кристаллы образуются различными способами. Они выделяются из сплава, раствора, или из паров кристаллических веществ и характеризуются тем, что геометрическое строение всех кристаллов одного и того же вещества одинаково. Эта правильность является результатом внутреннего строения кристаллов, которое удалось подробно исследовать при помощи рентгеновских лучей.
В. Рентген (1845 - 1923) обнаружил в 1895 г., что поток электронов, падающий в эвакуированной трубке на так наз. антикатод, вызывает сильное невидимое излучение, называемое лучами X или рентгеновскими лучами. Это - электромагнитные колебания, отличающиеся от обыкновенного света более короткой волной.
Основное открытие в исследовании внутреннего строения кристаллов сделал М. Лауэ в 1912 году, а дальнейшие исследования провели У. Г. и У. Л. Брэгги (отец и сын). Лауэ со своими сотрудниками обнаружил, что пучок Х-лучей, проходя через кристалл, отклоняется от своего первоначального направления (см. рис. 13), а попадая на чувствительную фотографическую пленку создает на ней правильную систему пятен разной величины; по их расположению можно судить о внутреннем строении кристалла. Оказалось, что частицы, из которых составлен кристалл, размещены в правильные пространственные решетки.
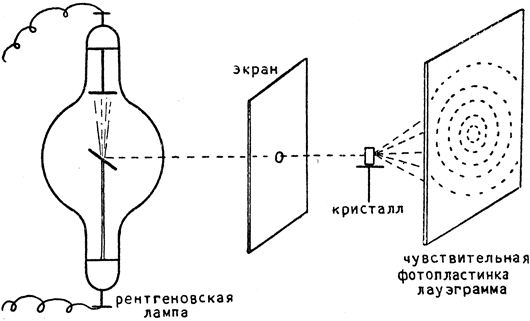
Рис. 13. Схема исследования кристаллов при помощи Х-лучей
По характеру тех частиц, которые входят в структуру кристалла, кристаллы подразделяются на ионные, атомные и молекулярные.
Примером простого ионного кристалла является кристалл хлористого натрия (NaCl). В его пространственной решетке кубической формы (рис. 14) ионы натрия Na+ чередуются с ионами хлористой соли Cl-. Внутри кристалла каждый ион Na+ окружен шестью соседними ионами Cl- и каждый ион Cl- шестью ионами Na+. Поэтому нет необходимости говорить об отдельных молекулах NaCl, так как весь кристалл представляет собою одну большую молекулу. Положительные и отрицательные ионы связаны друг с другом силами электростатического притяжения. Этим мы объясняем тот факт, что точка плавления хлористого натрия и прочих солей с ионными кристаллами так высока.
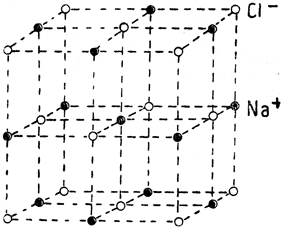
Рис. 14. Кристалл NaCl (ионный)
Важной величиной является расстояние между соседними ионами, которое мы называем константой решетки. Ее величина выражается в ангстремах.* Константа решетки хлористого натрия d = 2,81 А. Измерением большого числа различных ионных кристаллов было установлено, что ионы в кристаллах ведут себя как твердые шары определенного радиуса, который и является характерной особенностью иона. Этот радиус называется ионным радиусом и величина его выражается также в ангстремах, как указано в таблице 7.
*(В атомной физике расстояния обыкновенно выражаются в единицах, которые были названы именем шведского физика А. Ангстрема (1814 - 1874). Один ангстрем = А = 10 - 8 см. = 0,000 000 01 см.)
Если мы знаем ионные радиусы, мы можем высчитать расстояния между ионами в кристаллах. Напр. константа решетки хлористого калия KCl равняется сумме ионного радиуса К+ и ионного радиуса Сl-, т. е. 1,33 А + 1,80 А = 3,13 А (измерение дало величину 3,14 А).
Таблица 7
| Элемент | Ионный радиус в А |
| Li+ | 0,80 |
| Na+ | 0,98 |
| K+ | 1,33 |
| Rb+ | 1,50 |
| Ca+ | 1,75 |
| NH+4 | 1,45 |
| Be2+ | 0,34 |
| Mg2+ | 0,70 |
| Ca2+ | 0,99 |
| Sr2+ | 1,15 |
| Ba2+ | 1,35 |
| Zn2+ | 0,45 |
| Cd2+ | 0,60 |
| Hg2+ | 0,60 |
| F- | 0,33 |
| Cl- | 1,80 |
| Br- | 1,95 |
| J- | 2,20 |
| O2- | 1,90 |
| S2- | 1,45 |
| Se2- | 2,00 |
| Fe2- | 2,20 |
Ионы в кристаллической решетке не находятся в состоянии покоя, но они совершают непрерывные колебательные движения вокруг равновесных положений. Эти колебания тем сильнее, чем выше температура кристалла. При определенной температуре электростатические силы притяжения не могут удержать ионы вместе, и кристалл расплавится. Случится это при точке плавления (т. пл.). Это важная физическая константа твердого вещества; по ней вещества определяются и устанавливается степень их чистоты. В первом случае мы опираемся на тот установленный факт, что точка плавления каждого твердого вещества - это его характерная особенность, которая в общем неизменна (лишь незначительно зависит от давления).
Во втором случае мы опираемся на то обстоятельство, что примеси, находящиеся в веществе, понижают точку плавления. Поэтому при очистке вещества, напр. при разделении смесей с целью получить химически чистое вещество (символ), контролируется точка плавления полученных проб, и чистка проводится до тех пор, пока точка плавления очищаемого вещества не перестанет меняться. Это однако относится только к тем веществам, которые при плавлении химически не изменяются.
Расплав каждого ионного соединения содержит свободные ионы, из которых каждый плотно окружен противоположно заряженными ионами. Поэтому расплавы ионных соединений являются проводниками. Подобным же образом свободные ионы освобождаются при растворении, и поэтому растворы ионных соединений также проводники.
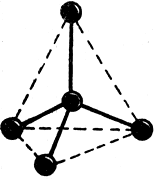
Рис. 15. Кристалл алмаза
Другую группу кристаллов образуют атомные кристаллы, т. е. состоящие из атомов. Атомная решетка построена здесь из атомов, соединенных ковалентными связями. Примером является кристалл алмаза (чистого углерода, рис. 15) или карборунда SiC. Кристалл алмаза, например, состоит из четырех правильных стен (тетраэдр), в углах которых находятся углеродистые атомы, связанные между собой электронными парами. Весь кристалл представляет собою огромную молекулу, составные части которой - углеродистые атомы - крепко связаны между собой. Отсюда проистекает трудность расщепления алмазов. Ввиду того, что электроны связаны крепко, алмаз не является проводником. Кристаллы графита (рис. 16) - пример слоистой решетки. Углеродистые атомы образуют правильные шестиугольники, размещенные в слоях. Ввиду того, что расстояние между слоями больше, чем расстояние между соседними углеродистыми атомами в шестиугольниках, графит легко расщепляется (в направлении слоев).
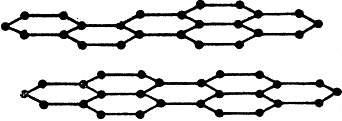
Рис. 16. Кристалл графита
У металлов кристаллическую решетку образуют катионы, между которыми свободно движутся оторвавшиеся электроны, так наз. электронный газ, чем обуславливается электропроводность металлов.
Третьим типом кристаллов являются кристаллы молекулярные (рис. 17), решетка которых состоит из отдельных молекул, удерживаемых вместе действием слабых молекулярных сил. Поэтому точка плавления веществ с молекулярной решеткой очень низкая.
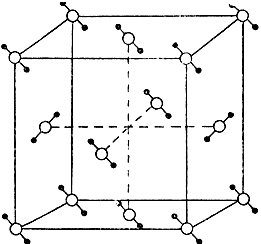
Рис. 17. Молекулярный кристалл (СО2)
Сюда относится значительное число органических соединений, напр. твердый метан (СН4), твердый четыреххлористый углерод (ССl4), твердый бензол (С6Н6), и неорганических соединений, напр. твердый углекислый газ (СО2), твердый водород, йод и т. п.
Согласно вышесказанному, мы называем однородную материю (гомогенную, во всех частях одинаковую) веществом. С точки зрения структуры веществом является такая материя, частицы которой (атомы, ионы, молекулы) расположены в пространстве определенным способом и образуют кристаллическую решетку. Вопрос о том, образует ли вещество кристаллическую решетку, можно решить физическими методами; важнейшим из них является исследование лучами X.
Исследование структуры веществ показало, что между структурой вещества и его химическим составом существует прямая зависимость. По структуре мы различаем твердые вещества с атомной, молекулярной, ионной и металлической структурой. Наглядно она изображена на рис. 18.
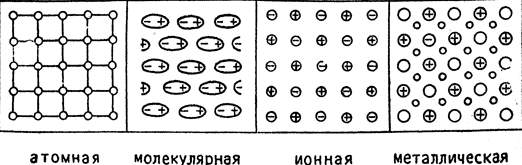
Рис. 18. Схематическое изображение разных структур вещества
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'