
1. Кислород
Кислород - это бесцветный газ, без вкуса и запаха. Негорюч, но сильно поддерживает горение. Кислород - самый распространенный элемент на земле. В свободном виде он является составной частью воздуха, в связанном - находится в кислородосодержащих минералах и почти во всех органических веществах. Соединяется почти со всеми элементами (за исключением редких газов) в окислы. Мы говорим, что элементы окисляются или оксидируются; реакции, проходящие при этом, называются реакциями окисления. Некоторые элементы окисляются уже при нормальной температуре действием кислорода воздуха (Рb), иные же только при сильном нагревании (Fe образует при калении окалину). Магний, углерод и сера горят на воздухе, образуя при этом окислы:
2 Mg + О2 = 2 MgO (окись магния)
С + О2 = СО2 (двуокись углерода)
S + О2 = SО2 (двуокись серы).
Действием кислорода окисляются также соединения. Так напр. метан, сгорая на воздухе, образует воду и углекислый газ:
СН4 + 2 О2 = СО2 + 2 Н2О
Особенно сильное окисление наступает под действием чистого кислорода, поставляемого в промышленность в стальных баллонах. Вещества, медленно окисляемые на воздухе, моментально загораяются в чистом кислороде и сгорают в окислы. Так напр. при автогенной резке сталь сильно нагревается и на раскаленное место подается кислород, превращающий железо в окисел (железо сгорает); тем самым нарушается связность материала.
Окисление - реакция экзотермическая. Если при окислении одновременно образуется свет, то мы говорим, что вещество горит. Горение, следовательно, это бурное окисление, т. е. соединение вещества (собственно элементов, из которых составлены горючие вещества) с кислородом воздуха.
Дыхание живых организмов - это по существу тоже окисление, но медленное и сопровождаемое образованием животного тепла. Кислород (собственно воздух) необходим таким образом для жизни всех организмов. Без воздуха существование живой природы невозможно (жизнь организмов в воде возможна потому, что в воде поглощено определенное количество кислорода).
Другим примером постепенного окисления являются тление и гниение (вызванное действием бактерий) или, наконец, коррозия металлов (напр. ржавление железа), вызванная электрохимическими свойствами металлов.
Соединения, легко отдающие кислород, мы называем окислителями. Самые известные из них - хлорат калия, нитраты, перекиси, бихроматы и т. д. Действие окислителей еще сильнее действия чистого кислорода. Мы объясняем это тем, что освобожденный из окислителя кислород является атомарным (действует раньше, чем атомы его соединились в молекулы О2).
Действие обратное окислению называется восстановлением или редукцией. Эту реакцию можно выразить так:
элемент - кислород = окисел (окисление)
окисел + кислород = элемент (восстановление).
При каждом окислении, следовательно, образуется окисел (или вещество богатое кислородом), а при каждом восстановлении - элемент (или вещество бедное кислородом).
Соединения, которые легко связывают кислород и даже отбирают его у веществ, содержащих кислород, мы называем восстановителями. Самые известные из них водород, углерод (кокс), алюминий и т. д. Примеры уравнений реакций восстановления:
2 ZnO + С = 2 Zn + СО2,
СuО + Н2 = Сu + Н2О,
Сr2О3 + 2 Al = Аl2О3 + 2 Сr.
Из приведенных примеров видно, что восстановление всегда связано с окислением. Так напр. в первом случае окись цинка восстанавливается в цинк, углерод же окисляется в СО2; СuО восстанавливается в Сu, а Н2 окисляется в Н2О и т. д.
Электронная теория соединений позволяет расширить значение понятий окисления и восстановления. Так напр., если соединяется Na с Cl в Na+Cl-, то получается вещество, о котором мы знаем, что оно состоит из ионов (катиона и аниона). Основой этой химической реакции является то, что более электроположительный атом отдал один электрон хлорному атому - элементу электроотрицательному, имеющему большое электронное сродство.
Вообще мы будем считать такую реакцию за окисление, а обратную - за восстановление, так что окисление - это такая химическая реакция, при которой электроны выделяются из атома или атомной группы, а восстановление - такая химическая реакция, при которой электроны принимаются атомами или атомными группами. Это видно из примеров:
Fe0 - 2e- = Fe2+ (свободное железо окисляется в соль закиси железа),
Fe2+ - e- = Fe3+ (закись железа окисляется в соль окиси железа),
Sn2+ - 2е- = Sn4+ (соль закиси олова окисляется в соль окиси олова),
Cl- - е- = Сl° (хлорид окисляется в хлор),
J- - e- = J° (иодистая соль окисляется в иод).
Из приведенных уравнений ясно, что при окислении заряды катионов (положительные) повышаются, а заряды анионов (отрицательные) понижаются.
Fe3+ + e- = Fe2+ (соль окиси железа восстанавливается в соль закиси железа),
Fe2+ + 2е- = Fe° (соль закиси железа восстанавливается в свободное железо),
Sn4+ + 2е- = Sn2+ (соль окиси олова восстанавливается в соль закиси олова),
J° + e- = J- (иод восстанавливается в иодистую соль),
Сl° + е- = Cl- (хлор восстанавливается в хлористую соль).
Из этого следует, что при восстановлении заряды катионов (положительные) понижаются, а заряды анионов (отрицательные) повышаются.
Так как обе реакции - окисления и восстановления - проходят одновременно, то окисление мы можем характеризовать как потерю электронов, а восстановление - как приобретение электронов. Таким образом восстановители освобождают электроны, а окислители их принимают.
Иногда вместо валентности приводится так наз. степень окисления элементов. Она может быть нулевая (у элементов свободных несоединенных), положительная, или, наконец, отрицательная, как это видно из таблицы 11.
Таблица 11
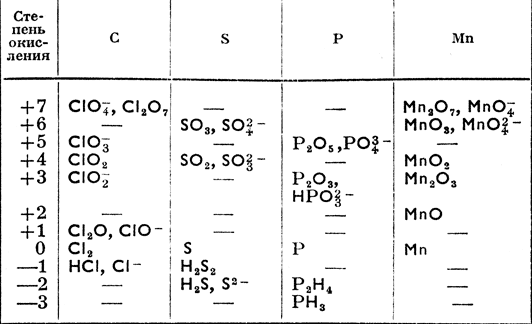
Для лабораторных опытов кислород получают нагреванием окиси ртути или хлората калия, которые разлагаются по уравнениям:
2 HgO = 2 Hg + О2,
2 КСlО3 = 2 KCl + 3 О2.
Разложение хлората калия протекает гораздо быстрее, если прибавить немного пиролюзита (МnО2, двуокиси марганца), который здесь действует как катализатор. Оба вещества, однако, должны быть абсолютно чистыми, иначе может произойти взрыв. Кроме того нагреванием двуокиси марганца (МnО2) или бихромата калия (К2Сr2O7) с серной кислотой можно получить небольшое количество кислорода.
Промышленная добыча кислорода основана на фракционной перегонке жидкого воздуха. Особенно большое количество кислорода расходуется при автогенной сварке и резке стали и чугуна. Вдуванием кислорода в пламя горящего газа (обыкновенно ацетилена) температура пламени повышается: у водорода до 2000°С, у светильного газа до 1800°С, у ацетилена даже до 3000°С. При такой температуре металлы можно сваривать без ковки или прессования. При автогенной сварке пользуются специальными горелками, в которые ацетилен и кислород подаются через толстые каучуковые шланги; таким образом смешивание обоих газов происходит непосредственно перед их сгоранием.
Небольшое количество кислорода применяется в медицине (при отравлении дымовыми газами или при удушьи). Чистый кислород выравнивает уравнение:
гемоглобин (красящее вещество крови) + кислород = оксигемоглобин,
т. е. в результате увеличенной концентрации кислорода при его вдыхании наступает оживление, а затем - нормальное дыхание.
Большое значение, напр. в горной промышленности, имеют кислородные дыхательные аппараты, которыми пользуются при спасательных работах в шахтах или при пожарах в тех случаях, когда необходимо проникнуть в помещения, где воздух был поглощен горением. В настоящее время большие количества кислорода расходуются при газификации топлива, для получения газов большой калорийности, и в металлургии вместо сжатого воздуха.
Действием электрических разрядов во время грозы, а также действием ультрафиолетового излучения из кислорода воздуха образуется озон, О3. Воздух больших городов не содержит озона, потому что он весь расходуется на окисление органических веществ. Сравнительно большое количество озона содержит воздух в деревне или морской. В технической практике озон не употребляется. Гораздо больше значение озонированного воздуха, который получается в результате действия переменного тока на воздух в озонаторах. Озонированный воздух содержит 0,3 - 2 г озона в 1 м3 и является отличным дезинфекционным и дезодорационным средством на сыроваренных заводах, в скотобойнях, на рыбоконсервных заводах и в продовольственных складах.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'