
2. Водород
Водород - горючий газ, бесцветный, без вкуса и запаха. В природе находится в связанном виде, как составная часть воды и почти всех органических соединений. Смесь водорода с воздухом (или кислородом) взрывчата. В лаборатории водород получается электролизом воды, или растворением в приборе Киппа (рис. 20) Zn в серной кислоте по уравнению: Zn + H2SО4 = ZnSО4 + H2. Его функция ясна из рисунка. При открытии крана к кислота из сосуда А стекает в сосуд Б и, соединяясь с цинком, образует водород. Если закрыть кран к, то кислота из сосуда Б давлением образовавшегося водорода выталкивается обратно в сосуд А. С помощью прибора Киппа в любую минуту может быть получен водород. В промышленности водород получается электролитическим разложением воды, или при электролизе NaCl. Атомарный водород - это или водород в стадии его образования, или водород, выдуваемый через электрическую дугу. Такой водород гораздо активнее, т. к. атомы его еще не соединены в молекулы.
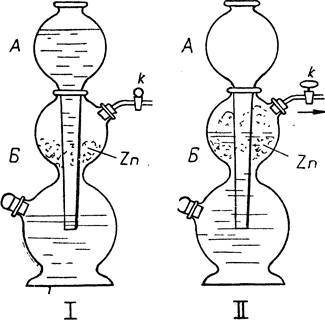
Рис. 20. Аппарат Киппа
В промышленности водородом пользуются для синтеза аммиака (NH3), хлористого водорода (HCl), при гидрогенизации угля (т. е. при производстве горючего из угля), а также для отвердения растительных масел. При нормальной температуре водород мало реактивен; при горении сгорает в воду: 2 Н2 + О2 = 2 Н2О. При высокой температуре он соединяется и со связанным кислородом окислов, образуя воду, т. е. восстанавливая окислы в металл. Напр. СuО + Н2 = Сu + Н2О. С прочими элементами он образует так наз. гидриды. Мы различаем гидриды неметаллов, которые не разлагаются водой; их растворы содержат электроположительный водород (Н2О, H2S, NH3, РН3, AsH3, СН4, SiH4, HCl, HBr, HF, HJ), и гидриды металлов (LiH, NaH, CaH2), которые водой разлагаются по уравнению NaH + Н2О = NaOH + Н2; их сплавы содержат электроотрицательный водород и положительно заряженный металл, напр. Na+H- (см. рис. 21).
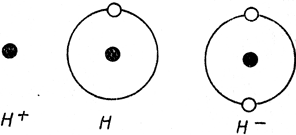
Рис. 21. Схема водородного атома и его ионов
Из всех известных веществ водород имеет самую большую теплотворную способность (1 кг водорода, сожженный в водяной пар, дает 28 550 ккал, 1 м3 водорода 2570 ккал) и является поэтому причиной большой калорийности некоторых технических газов (водяной газ, светильный газ и т. д.).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'