
6. Нейтрализация. Амфотерные окислы
Если известное количество кислоты соединяется с основанием такой же силы, то такое химическое изменение называется нейтрализацией. Напр. в раствор азотной кислоты прибавляется раствор едкого калия до тех пор, пока индикатор не покажет нейтральное состояние раствора (лакмус окрасится в фиолетовый цвет, метилоранж - в цвет лука). Таким образом нейтрализацию азотной кислоты можно выразить химическим уравнением: HNO3 + КОН = KNО3 + Н2О. Вещество, образовавшееся в результате нейтрализации, не имеет ни кислотных, ни щелочных свойств и называется солью. Если выпарить образовавшийся раствор, то получится азотнокислый калий, KNO3, соль азотной кислоты.
Как видно, можно теоретически вывести любую соль любой кислоты простой заменой водорода в кислоте соответствующим металлом. По количеству водорода, который можно заменить металлом, мы различаем кислоты одноосновные (HNO3, HF, HCl), двуосновные (Н2СО3, H2SО4) и трехосновные (Н3РО4). Но основность кислоты не должна непременно согласоваться с числом атомов водорода в ее молекуле. Напр. фосфористая кислота, Н3РО3 - двуосновная и т. п.
Основность оснований дается числом гидроксилов (т. е. -ОН групп) в молекуле основания. В таком случае КОН - одноосновное основание, Са(ОН)2 - двуосновное, Fe(OH)3 - трехосновное и т. д.
Кроме окислов кислотных и основных, мы знаем еще окислы амфотерные. Их гидраты в воде нерастворимы. Их амфотерность проявляется в том, что с кислотами они реагируют как основания, а с основаниями - как кислоты. Это видно из уравнения:
Zn(OH)2 + 2 HNO3 = 2 H2О + Zn(NO3)2 (азотнокислый цинк),
Zn(OH)2 + 2 КОН = 2 Н2О + K2ZnО2 (цинкат калия),
Аl(ОН)3 + 3 HCl = 3 Н2О + АlСl3 (хлористый алюминий),
Аl(ОН)3 + КОН = 2 Н2O + КАlO2 (алюминиевокислый калий).
Наконец нам известны и такие окислы (СО, NO, СlО2), из которых нельзя получить ни кислоты, ни основания.
Формула соли выводится так же, как формула бинарных соединений, т. е. валентность должна равняться основности кислоты. Напр.:
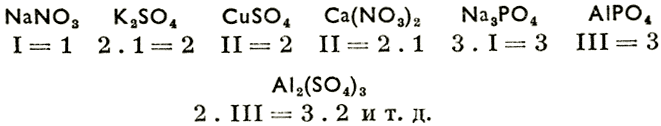
Если все атомы водорода в кислоте заменить металлом, то образуются нормальные соли. Если же заменяется только часть атомов водорода кислоты, то образуются кислые или вторичные соли (т. е. кислоты одноосновные дают соли нормальные, кислоты двуосновные - соли кислые и нормальные, а кислоты трехосновные дают все три вида). Кислые соли получаются, следовательно, в результате частичной нейтрализации кислоты. Напр. H2SО4 + КОН = Н2О + KHSО4 (кислый сернокислый калий). Аналогично частичной нейтрализацией оснований образуются основные соли. Напр. Fe(OH)3 + HNO3 = Н2О + Fe(OH)2NO3 (основное азотнокислое железо).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'