
7. Электролитическая диссоциация
Наблюдения за состоянием веществ во время действия постоянного электрического тока показали, что вещества можно разделить на:
1. непроводники, которые применяются для изоляции электрического тока (стекло, фарфор);
2. проводники
а) первого разряда - те вещества, которые под действием электрического тока не меняются и поэтому служат для распределения электрического тока (металлы и углерод),
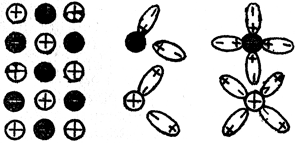
Рис. 22. Гидратация ионоэ
б) второго разряда - те, которые электрическим током разлагаются, иначе - поддаются электролизу. Это водные растворы кислот, оснований и солей. Называются они электролитами. Шведский ученый Сванте Аррениус (1859 - 1927) уже в 1887 году изложил теорию проводимости электрического тока растворами кислот, оснований и солей. Он полагал, что молекулы электролитов при растворении расщепляются (диссоциируются) в ионы - частицы с электрическим зарядом. Теперь же нам известно, что ионы в ионных соединениях расположены в кристаллической решетке и что при расплавлении кристаллов, или при растворении их в воде, кристаллическая решетка разрушается, в результате чего ионы могут свободно перемещаться. В других случаях, напр. в кислотах HCl и H2SО4, диссоциация происходит только под действием растворителя. На рис. 22 изображена так наз. гидратация ионов, которая происходит таким образом, что дипольные молекулы воды образуют вокруг ионов как бы оболочку (которая ориентирована у катиона противоположно аниону). На рис. 23 схематически изображена диссоциация полярной молекулы. Полярная молекула под влиянием растворителя переходит в ионную и наконец распадается на ионы.
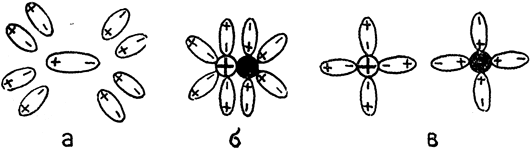
Рис. 23. Диссоциация полярной молекулы
Растворы меньшей концентрации (разбавленные) бывают обыкновенно лучшими проводниками, чем концентрированные. Объясняется это тем, что при меньшей концентрации ионы этих растворов более подвижны; в концентрированных же растворах ионы мало подвижны: силы электростатического притяжения удерживают их в тесной близости друг к другу. Степень диссоциации зависит таким образом от количества воды (растворителя), но лишь в границах предельного разбавления. Степень диссоциации повышается при разбавлении раствора и понижается при его испарении. Диссоциация - реакция обратимая и выражается химическими уравнениями, в которых вместо знаков равенства пишутся стрелки:
NaCl 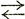 Na+ + Сl-,
Na+ + Сl-,
 Na+ + Сl-,
Na+ + Сl-,КОН 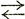 К+ + ОН-,
К+ + ОН-,
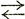 К+ + ОН-,
К+ + ОН-,HNО3 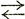 H+ + NO-3,
H+ + NO-3,
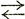 H+ + NO-3,
H+ + NO-3,H2SО4 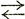 2 Н+ + SO2-+,
2 Н+ + SO2-+,
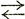 2 Н+ + SO2-+,
2 Н+ + SO2-+,Al2(SО4)3 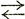 2 Аl3+ + 3 SO2-4 и т. д.
2 Аl3+ + 3 SO2-4 и т. д.
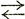 2 Аl3+ + 3 SO2-4 и т. д.
2 Аl3+ + 3 SO2-4 и т. д.
Степень диссоциации зависит и от так наз. константы диссоциации, которая напр. для разбавленной азотной кислоты будет  . Ее можно установить на основании электропроводности разбавленной азотной кислоты. Для того, чтобы установить степень диссоциации различных электролитов, все же нужно брать растворы одинаковой концентрации.
. Ее можно установить на основании электропроводности разбавленной азотной кислоты. Для того, чтобы установить степень диссоциации различных электролитов, все же нужно брать растворы одинаковой концентрации.
Как видно из уравнений диссоциации, кислоты содержат катионы Н+, а основания - анионы ОН-. Повсюду, где кислота соприкасается с основанием, наступает моментальная нейтрализация. Напр. HNO3 + NaOH = NaNO3 + H2О. Так как вместо HNО3 можно взять любую другую кислоту и вместо NaOH любое другое основание, то все возможные случаи нейтрализации можно выразить общим, так наз. ионным уравнением: Н+ + ОН- = Н2О. То же происходит и при других химических реакциях. Напр. уравнение Ва2+ + SO2-4 = BaSО4 - читается: все растворимые соединения бария образуют с растворимыми сульфатами или с серной кислотой практически нерастворимыйBaSО4. Уравнение Cd2+ + S2- = CdS - читается: все растворимые соединения кадмия образуют с растворимыми сульфидами или с сероводородом нерастворимыйCdS. Таким образом в ионных уравнениях ионы обозначают соответствующие растворимые соединения, цельные же молекулы обозначают вещества нерастворимые (слабо диссоциированные).
Сила кислот и оснований зависит от числа свободных Н+ и ОН- ионов. Следовательно, кислота (основание) будет тем сильнее, чем большее число Н+ (ОН-) она передаст в раствор, иначе чем более она будет расщеплена на ионы, при той же степени разбавления раствора. Мерой расщепляемости является степень диссоциации кислот и оснований одинаковой концентрации, согласно которой кислоты и основания можно разделить по данным табл. 12.
Таблица 12
| Cила | Кислоты | Основания |
| Сильные | HCl, HBr, HJ, HClO3, HClO4, HNO3, H2SO4, HCNS | KOH, NaOH, Ca(OH)2, Ba(OH)2 и Sr(OH)2 |
| Cредне-сильные | HF, H3PO4, H2SO3, щавельная | - |
| Слабые | Н2СО3, H2S, H3BO3 и некоторые органические кислоты | AgOH, NH4OH и нерастворимые в воде металлические гидроокиси |
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'