
8. Водородный показатель
Химически чистая вода обладает незначительной степенью диссоциации, согласно уравнению H2О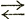 Н+ + ОН-. Следовательно, здесь действительно соотношение k =
Н+ + ОН-. Следовательно, здесь действительно соотношение k = 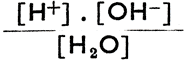 , где выражения в квадратных скобках означают молярную концентрацию соответствующих продуктов (т. е. число молей в литре). Так как электролитическая диссоциация воды весьма незначительна, то [Н2О] можно считать постоянной величиной; следовательно, [Н2О] = к|. Подставив это выражение в первоначальное уравнение, получим k' =
, где выражения в квадратных скобках означают молярную концентрацию соответствующих продуктов (т. е. число молей в литре). Так как электролитическая диссоциация воды весьма незначительна, то [Н2О] можно считать постоянной величиной; следовательно, [Н2О] = к|. Подставив это выражение в первоначальное уравнение, получим k' = 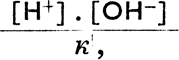 , откуда [Н+] * [ОН-] = к', к" = к' * к" = К. К является конечной константой, величина которой зависит от температуры. На основе опытов было определено, что при температуре 22°С К = 10-14. Так как вода практически нейтральна, то здесь действительно равенство [Н+] = [ОН-]. Подставив это выражение получим: [Н+] * [ОН-] = [Н+]2 = 10-14, откуда [Н+] =
, откуда [Н+] * [ОН-] = к', к" = к' * к" = К. К является конечной константой, величина которой зависит от температуры. На основе опытов было определено, что при температуре 22°С К = 10-14. Так как вода практически нейтральна, то здесь действительно равенство [Н+] = [ОН-]. Подставив это выражение получим: [Н+] * [ОН-] = [Н+]2 = 10-14, откуда [Н+] = 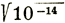 = 10-7.Так же и [ОН-] = 10-7. Прологарифмировав уравнение [Н+] = 10-7, получим log Н+ = -7, что действительно для нейтрального состояния. Обратный логарифм концентрации водородных ионов является водородным показателем рН, так что рН = - log [Н+].
= 10-7.Так же и [ОН-] = 10-7. Прологарифмировав уравнение [Н+] = 10-7, получим log Н+ = -7, что действительно для нейтрального состояния. Обратный логарифм концентрации водородных ионов является водородным показателем рН, так что рН = - log [Н+].
Из вышесказанного вытекает, что в нейтральном растворе рН = 7. В кислом растворе концентрация Н+ будет выше, и поэтому рН будет меньше 7. В щелочном растворе рН больше 7. Водородный показатель какой-либо среды определяется путем определения электропроводимости, или при помощи универсальных индикаторов (или специальных реактивных бумаг), окраска которых после соприкосновения с испытуемой средой сопоставляется со стандартной цветной шкалой. Связь рН растворов с нормальностью HCl и NaOH (сильные кислоты и основания) указана в таблице 13.
Таблица 13


|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'