
9. Гидролиз
Если растворить в воде соль сильной кислоты и сильного основания (напр. NaCl, K2SO4, NaNO3 и т. д.), то этот раствор будет иметь нейтральную реакцию. Реакция будет иная, если растворить в воде соль сильного основания и слабой кислоты, или же наоборот. Так например раствор АlСl3 (соль сильной кислоты и слабого основания) дает кислую реакцию, раствор Na2S (соль слабой кислоты и сильного основания) дает щелочную реакцию. Убедиться в этом просто - прибавить в раствор индикатор.
Такая реакция разложения, вызванная тем, что ионы растворенного вещества реагируют с ионами воды, называется гидролизом. Соли кислот и оснований разных сил являются гидролитически расщепленными.
Гидролиз противоположен нейтрализации, что ясно из уравнений:
АlСl3 + 3 Н2О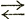 Аl(ОН)3 + 3 HCl
Аl(ОН)3 + 3 HCl
Na2S + 2 Н2О → 2 NaOH + 2 H2S, которые можно написать таким образом:
Аl3 + 3 Cl- + 3 Н+ + 3 ОН 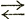 Аl(ОН)3 + 3 Н+ + 3 Сl-
Аl(ОН)3 + 3 Н+ + 3 Сl-
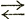 Аl(ОН)3 + 3 Н+ + 3 Сl-
Аl(ОН)3 + 3 Н+ + 3 Сl-2 Na+ + S2- + 2 Н+ + 2 ОН 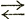 2 Na+ + 2 ОН- + 2 H2S
2 Na+ + 2 ОН- + 2 H2S
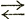 2 Na+ + 2 ОН- + 2 H2S
2 Na+ + 2 ОН- + 2 H2SИз первого уравнения видно, что в растворе встречаются ионы Аl3+ и ионы ОН-, относящиеся к весьма слабому основанию, которое слабо диссоциировано. Поэтому они притягиваются друг к другу (в некоторых случаях наступает так наз. ассоциация, т. е. возникновение сплошных молекул), чем нарушается равновесие, и дальнейшие молекулы воды расщепляются в ионы Н+ и ОН- до тех пор, пока в растворе не останется избыток Н+, т. е. раствор приобретет кислую реакцию.
При гидролизе некоторых металлических солей (Sn2+, Bi3+) возникают гидролитические продукты, в форме осадков; так что при растворении этих солей в воде, растворы тем больше мутнеют, чем больше мы прибавляем воды. Напр.
BiCl3 + Н2О 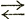 BiOCl + 2 HCl,
BiOCl + 2 HCl,
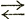 BiOCl + 2 HCl,
BiOCl + 2 HCl,т. е. мало диссоциированная BiOCl (хлорокись висмута) образует сплошные молекулы и выпадает из раствора в виде осадка.
Чтобы воспрепятствовать гидролизу, к раствору с кислой реакцией прибавляется немного кислоты, а к раствору со щелочной реакцией - немного щелочи. Таким образом реакция переместится в направлении ←. Поэтому при получении растворов некоторых химикатов нужно не забыть прибавить в раствор кислоты. Иначе могут возникнуть нерастворимые продукты гидролиза, которые с трудом образуют растворы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'