
11. Группа серы
Сера представляет вещество (элемент) светло-желтого или темно-желтого (медового) цвета. Не имеет ни вкуса, ни запаха. Точка плавления серы около 114°С. Сера известна в нескольких разновидностях; среди них наиболее постоянна и чаще всего встречается в природе ромбическая сера. Сера - элемент активный: при повышенной температуре она соединяется почти со всеми другими элементами (за исключением N, J, Pt и Аu). Зажженная на воздухе горит синим пламенем, образуя SО2. В природе встречается в свободном состоянии (поблизости от вулканов, вросшая в камни) и в связанном состоянии в форме сульфидов металлов (колчеданы, блески, обманка) или сульфатов (гипс, барит); она входит также в состав органических веществ (белковые вещества и эфирное масло). Сера добывается путем выплавки из вулканических пород (Сицилия) или из отходов массы газа. Известна черенковая сера и кристаллический серный цвет. Применяется сера для вулканизации каучука, фейерверков, производства сернистых красителей, соединений серы и т. д. Тонко распыленная так наз. коллоидная сера используется в косметике и ветеринарии. В соединении с водородом сера двухвалентна, а в соединении с кислородом - четырехвалентна и шестивалентна.
Сероводород, H2S - бесцветный газ с запахом тухлых яиц. Ядовит. В природе образуется разложением сульфидов и в результате гниения органических веществ; поэтому содержится в газах каналов и в кишечных газах. В лабораториях его получают в аппаратах Киппа путем действия кислот FeS согласно уравнению FeS + 2 HCl = FeCl2 + H2S. Сероводород горит синеватым пламенем с образованием двуокиси серы и воды. Самое большое количество H2S расходуется на определение соединений металлов. Если в раствор солей металлов ввести H2S, происходит выделение сульфидов, окрашенных в различные цвета. В воде сероводород растворяется образуя сероводородную воду, используемую в аналитической химии. Присутствие небольшого количества H2S в воздухе является причиной того, что серебряные предметы чернеют. H2S является слабой кислотой, соли которой называются сульфидами. Сульфиды бывают кислые (KHS, Ca(HS)2), средние (K2S, BaS), полисульфиды (Na2S3, Na2S5). Кислые и средние сульфиды под действием кислот выделяют H2S. Полисульфиды наряду с H2S образуют коллоидную серу, а ее водные суспензии - так наз. серное молоко (осажденная сера) по уравнению: Na2S3 + H2SО4 = Na2SО4 + H2S + 2 S. Обжиг сульфидов, т. е. нагревание их в струе воздуха с использованием температуры, при которой они еще не плавятся, имеет большое значение для металлургии. В результате обжига руды, сульфиды, содержащиеся в ней, меняются в кислоты и SО2, который улетучивается. Таким образом из руды удаляется вредная сера. В промышленности самым важным является обжиг колчедана: 4 FeS2 + 11 O2 = 2 Fe2O3 + 8 SО2, так как железный колчедан FeS2 - основное сырье для производства серной кислоты.
Двуокись серы (сернистый газ), SО2, представляет собою бесцветный газ с едким запахом, кислый на вкус, негорючий и ядовитый. Вызывает сильный кашель. Его раствор в воде - сернистая кислота, H2SO3 * SО2. Двуокись серы получается путем сжигания серы, обжига сульфитов или разложения солей сернистой кислоты - так наз. сульфитов - кислотами. В природе встречается в газах вулканических извержений и является составной частью дымовых газов. Поэтому в незначительном количестве сернистый газ содержится в воздухе промышленных городов, что приносит значительный вред растительности. Кроме того он разрушает железные предметы, штукатурку и т. п. SO2 применяется для дезинфекции помещений, для отбелки шерсти, клея, сахарных растворов, для окуривания бочек и т. д. Сернистая кислота неустойчива. Ее солями являются сульфиты - кислые (NaHSО3) и средние (Na2SO3). Так как не только H2SО3, но и ее соли легко окисляются с образованием H2SО4, или сульфатов, то H2SOa и сульфиты являются сильными восстановителями. При кипячении с серой они переходят в тиосульфаты (серноватистокислые соли), напр. Na2SО3 + S = Na2S2О3 - тиосульфат натрия. Метабисульфиты образуются реакцией: K2SO3 + SО2 + K2S2О5. Гидросульфиты образуются согласно уравнению: 2 NaHSО3 + Zn + SО2 = ZnSO3 + H2О + Na2S2О4. Так как метабисульфиты и гидросульфиты - восстановители, они используются в фотографии и для обесцвечивания жиров и сахарных растворов. Хлористый тионил, SOCl2, бесцветная жидкость с удушливым запахом. Используется для хлорирования органических соединений.
Трехокись серы, SO3, представляет собою белую кристаллическую массу. Точка плавления 17°С. На воздухе сильно дымится, с водой бурно соединяется. Поэтому ее необходимо хранить в запаянных сосудах. Возникает путем окисления SО2 кислородом воздуха, однако окисление проходит очень медленно. В промышленности эта реакция ускоряется подходящим катализатором и является основой так наз. контактного производства серной кислоты.
Серная кислота, H2SО4, - бесцветная жидкость без запаха, с точкой кипения 338°С, сильно едкая. На коже оставляет опасные ожоги. С водой смешивается в любых соотношениях с выделением значительного количества тепла. При разбавлении ее водой всегда наливаем кислоту в воду, а не наоборот (кислота могла бы брызнуть в глаз). В разбавленной серной кислоте растворяются некоторые металлы (с выделением водорода), напр. Fe и Zn. На другие металлы (Ag, Сu, Hg, Sb) действует только концентрированная серная кислота, причем образуется SO2. На благородные металлы серная кислота не действует. Так как она не действует и на чугун, то многие реакции можно проводить в чугунных сосудах. Концентрированная серная кислота не действует и на мягкое железо, конечно, при нормальной температуре, и поэтому ее можно транспортировать в железных бочках. Серная кислота - важнейшее вспомогательное сырье химической промышленности. Ее называют "кровью химической промышленности". Производится серная кислота из SО2, полученного обжигом пирита более старым методом - так наз. камерным, или методом контактным. При камерном способе SO2 соприкасается с воздухом и водяным паром в больших свинцовых камерах (свинец не разрушается серной кислотой), с образованием серной кислоты по уравнению: SO2 + Н2О + О = H2SО4. При контактном способе протекает следующая реакция: SО2 + О = SO3. Во время этой реакции смесь SО2 и воздуха проводится через катализатор (V2О5) и образующаяся SО3 улавливается или водой, в результате чего возникает серная кислота, или серной кислотой, в результате чего возникает дымящая серная кислота, или олеум (обычно содержит 20% и 60% SO3). Серная кислота находит широкое и разнообразное применение. Она используется для очистки минеральных масел, в аккумуляторах, для сульфирования органических соединений, для производства суперфосфата, сульфатов, других кислот, в производстве взрывчатых веществ нитрацнейи т. д. Ее солями являются сульфаты - кислые (NaHSO4) и средние (Na2SО4). Надсерная кислота, H2S2O8, получается при электролизе серной кислоты. Технически важны ее соли персульфаты, напр. K2S2O8, (NH2)S2О8, применяемые в качестве сильных окислителей для отбелки и в фотографии. Хлорсульфоновая кислота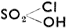 представляет собою бесцветную жидкость с резким запахом. Возникает действием HCl на SO3 и является самым сильным сульфирующим средством. Хлористый сульфурил, SО2Cl2, получается из SО2 и хлора; это бесцветная резко пахнущая жидкость. Применяется для хлорирования органических соединений. Хлористая сера, S2Cl2, образуется при пропускании хлора через расплавленную серу. Это темно-желтая жидкость с неприятным запахом. Применяется для холодной вулканизации каучука. СероуглеродCS2 представляет собою бесцветную жидкость; точка кипения 46°С. В чистом виде обладает запахом эфира, со временем приобретает весьма неприятный запах гнилой капусты. Пары его на воздухе взрываются; поэтому его нельзя перегонять при помощи воздуха, а надо пользоваться для этого СО2, причем на поверхности CS2 должен постоянно находиться слой воды. Раньше сероуглерод применялся для экстрагирования. В настоящее время он используется в производстве вискозного шелка и тиокарбонатов в соединении с сульфидами (CS2 + Na2S = Na2CS3), известными средствами для борьбы с вредителями растений.
представляет собою бесцветную жидкость с резким запахом. Возникает действием HCl на SO3 и является самым сильным сульфирующим средством. Хлористый сульфурил, SО2Cl2, получается из SО2 и хлора; это бесцветная резко пахнущая жидкость. Применяется для хлорирования органических соединений. Хлористая сера, S2Cl2, образуется при пропускании хлора через расплавленную серу. Это темно-желтая жидкость с неприятным запахом. Применяется для холодной вулканизации каучука. СероуглеродCS2 представляет собою бесцветную жидкость; точка кипения 46°С. В чистом виде обладает запахом эфира, со временем приобретает весьма неприятный запах гнилой капусты. Пары его на воздухе взрываются; поэтому его нельзя перегонять при помощи воздуха, а надо пользоваться для этого СО2, причем на поверхности CS2 должен постоянно находиться слой воды. Раньше сероуглерод применялся для экстрагирования. В настоящее время он используется в производстве вискозного шелка и тиокарбонатов в соединении с сульфидами (CS2 + Na2S = Na2CS3), известными средствами для борьбы с вредителями растений.
Селен и теллур встречаются редко. Это неметаллические элементы, соединения которых подобны соединениям серы. Техническое значение имеет серый селен, так как его электропроводность меняется в зависимости от освещения (клетки селена).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'