
12. Группа азота
Азот - бесцветный газ без вкуса и запаха, негорюч. В смеси с кислородом (в атмосфере) им можно дышать. В чистом азоте тухнет пламя, и живые организмы погибают от недостатка кислорода. Азот мало активен, с водородом соединяется только при высокой температуре и давлении. С металлами соединяется только при высокой температуре с образованием нитридов (AIN, Mg3N2) B природе находится в свободном состояний (в атмосфере) и связанный - в виде соединений. Эти соединения могут быть неорганическими (соли аммония, аммиак и нитраты), или органическими (мочевина, белки). Азот - важный биогенный элемент. Растения принимают так наз. почвенный азот, образующийся при разложении органических веществ (отходов растительного и животного мира) в почве в виде аммиачного азота, который под действием нитробактерий переходит в нитратный азот. Этим азотом питаются растения. Поэтому навоз, соли аммония и нитраты - всё это известные удобрения. Производство азота проводится путем фракционированной перегонки жидкого воздуха. Азот поставляется в стальных баллонах и применяется для перегонки или защиты горючих жидкостей. Больше всего азота расходуется в производстве аммиака.
Соединения азота с водородом - аммиакNH3, гидразинNH2NH2 и азоимид N3H; их электронные формулы пишутся так:
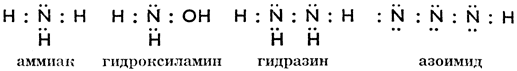
Аммиак - это бесцветный газ, с острым специфическим Запасом, ядовитый и щелочного характера. Доставляется в жидком виде в баллонах, или как едкий аммиак (нашатырный спирт) NH4OH, раствор аммиака в воде. Раньше получался исключительно из аммиачной воды газовых и коксовых заводов. Сейчас аммиака вырабатывается гораздо больше путем синтеза согласно уравнению: N2 + 3 H2 = 2 NH3, при высоких давлении и температуре в присутствии катализаторов. Кроме того аммиак можно получить связыванием азота атмосферы, пропуская его через карбид кальция; образуется цианамид кальция, который под действием перегретого пара выделяет аммиак: СаС2 + Na = CaCN2 + С, CaCN2 + 3 Н2O = СаСО3 + 2 NH3. Цианамид кальция, иначе азотистая известь, - известное удобрение. Аммиак является вспомогательным сырьем при производстве соды, средством для чистки, хладагентом холодильных машин и сырьем для производства соединений аммония. В машиностроительной промышленности аммиак применяется для азотирования, т. е. поверхностного отвердения стали. Из производных аммиака самые известные NCl2, хлористый азот, NJ2, иодистый азот; это опасные взрывчатые вещества.
Соединения аммония образуются добавлением аммиака в кислоты, согласно уравнению: NH3 + HCl = NH4Cl, NH3 + HNО3 = NH4NО3, 2 NH3 + H2SО4 = (NH4)2SО4. Эти соединения содержат катион аммония NH+4, который содержится и в едком аммиаке: NH3 + Н2О = NH4OH. Гидроксиламин, NH2OH, образует гигроскопические кристаллы, гидразин, NH2NH2, - бесцветную жидкость, дымящую на воздухе. Оба в соединениях с кислотой, подобно аммиаку, образуют соли. Имеют значение как восстановители. Азоимид (азотистоводороднан кислота) - это бесцветная неустойчивая, сильно эндотермическая жидкость; поэтому она взрывчата. Ее соли (азиды), напр. Pb(N3)2 или AgN3, применяются как взрывчатые вещества.
Среди окислов азота самой важной является закись азота, N2O, со структурной формулой N ≡ N = О; от нее образуется азотноватистая кислотаH2N2О2. Закись азота (в смеси с кислородом) применяется как "веселящий газ" для наркоза. Азотистый ангидрид,N2О3, устойчив только при низкой температуре, от него образуется азотистая кислота, HNО2. Азотный ангидрид, N2О5, образует бесцветные кристаллы, неустойчив, является ангидридом самого важного соединения азота, азотной кислоты, HNO3.
Первоначально азотная кислота производилась из чилийской селитры. Теперь обычно ее получают сжиганием аммиака, по уравнению: 4 NH3 + SО2 = 4 NO + 6 Н2О, пропуская смесь аммиака и воздуха через платиновый катализатор. Образовавшаяся NO путем дальнейшего окисления переходит в NО2, поглощаемую водой. HNО3 - бесцветная или желтоватая, сильно едкая жидкость. Растворяет почти все металлы (за исключением Аu и платиновых металлов). Кроме того оказывает сильное окисляющее действие (серу окисляет в серную кислоту, фосфор - в фосфорную, Sn - в оловянную кислоту и т. п.). Органические вещества азотная кислота либо окисляет, либо нитрует. Ее используют при производстве взрывчатых веществ (нитроцеллюлозы и нитроглицерина и т. д.), а также при травлении металлов. Смесь трех частей концентрированной HCl и одной части концентрированной HNО3 называется царской водкой. Обращаться с царской водкой надо осторожно, так как она сильно разъедает кожу, окрашивая ее в желтый цвет. Соли HNО3 - это нитраты; из них самые известные: селитра обыкновенная, KNО3, чилийская селитра, NaNO3, аммиачная селитра, NH4NO3, и норвежская селитра, Ca(NО3)2 (остравская). Нитраты при более высокой температуре разлагаются и действуют как сильные окислители (огнестрельный порох - смесь KNО3 + S в виде порошка и древесного угля).
Фосфор в природе встречается не в свободном состоянии, а в виде соединений - фосфатов. Самый известный из них гипофосфат кальция, Са3(РО4)2, который известен в виде минерального в натуральных фосфатах (Алжир, Флорида СССР) или в виде животного - является составной частью костей. Фосфор - необходимая составная часть организмов растений и животных (белковые вещества). Растения при помощи корней получают фосфор из почвы в виде растворимых фосфатов и собирают их в семенах, откуда фосфор уже в органически связанном виде переходит к животным организмам. Поэтому недостаток фосфора в почве надо пополнять удобрением. Известные виды фосфора:
1. Белый фосфор - слабо-желтоватое вещество, твердое, как воск. При нагревании до 40°С фосфор загорается, поэтому его нужно хранить под водой. Горящий фосфор опасен, т. к. оставляет на коже тяжелые ожоги. Фосфор горит с образованием белого дыма - фосфорного ангидрида, Р2О5. Белый фосфор весьма ядовит.
2. Красный фосфор - порошок лиловатого оттенка без запаха и вкуса, образуется из белого фосфора при нагревании без доступа воздуха. Зажженный красный фосфор горит так же, как белый, но не ядовит и воспламеняется только при 260°С.
В промышленности фосфор производится по уравнению: Са3(РО4)2 + 3 SiО2 + 5 С = 3 CaSiО3 + 5 СО + 2 Р в электрической печи. Самое большое количество фосфора используется при производстве Н3РO4 сжиганием, из него производится также красный фосфор, слоем которого покрывают поверхность спичечных коробок (рис. 24). Не большое количество фосфора используется для производства фосфидов (в сплавах). Фосфористый водород, РН3, - бесцветный газ с запахом рыбы. Фосфористый водород, Р2Н4 - самовоспламеняющаяся жидкость. Треххлористый фосфор, РСl3, и пятихлористый фосфор, РСl5 производятся действием Cl на фосфор. Они служат для хлорирования органических соединений. Среди сульфидов фосфора самым важным является P4S3. Это желтоватый порошок; из него изготовляются головки спичек, которые зажигаются от трения о любую шероховатую поверхность.
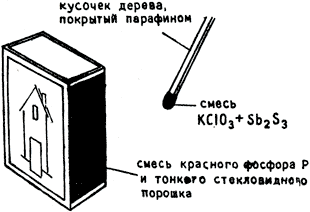
Рис. 24. Схема спичек
Фосфорный ангидрид, Р2О5, получается при сжигании белого фосфора. Это белый порошок, образующий соединением с водой фосфорные кислоты по уравнениям: Р2О5 + Н2О = 2 НРО3 (метафосфорная кислота), Р2О5 + 2 Н2О = Н4Р2О7 (пирофосфорная кислота) и Р2О5 + 3 Н2О = 2 Н3РО4(ортофосфорная кислота). Говоря о фосфорной кислоте или о фосфатах, мы всегда подразумеваем ортофосфорную кислоту и ее соли, так наз. ортофосфаты, которые могут быть нормальными, средними и кислыми. Напр. нормальные Na3PО4, Са3(РО4)2 и АlРО4, средние Na2HРО и СаНРО4 и кислые NaH2PО4 и Са(Н2РО4)2. Фосфорная кислота - это густая жидкость, кислая на вкус. В чистом виде ее используют для приготовления лимонадов и в виде составных частей лекарств. Техническая фосфорная кислота является сырьем для производства двойного суперфосфата (т. е. суперфосфата, содержащего 40 - 45% Р2О5) и активированного угля.
Мышьяк по своим свойствам, особенно в соединениях, подобен фосфору и сурьме. Мышьяк известен в нескольких видах; самым известным является металлический (серый) мышьяк. Это серебристое блестящее хрупкое вещество, возгоняющееся при 450°С, предварительно не расплавляясь. В природе мышьяк находится в виде мышьякового колчедана FeAsS и двумышьяковистого железа FeAs2. Мышьяк получается нагреванием мышьяковистых руд, которые разлагаются согласно уравнениям: FeAsS = FeS + As или FeAs2 = FeAs + As. В технике мышьяк используется мало. Небольшое количество металлического As используется при изготовлении дроби (приблиз. 0,5%). Он служит также для производства соединений. Мышьяковистый водород, AsH3, выделяется из всех соединений мышьяка под действием водорода в момент образования. Этот факт используется при так наз. пробе Марша для определения наличия мышьяка (особенно в судебной химии для установления факта отравления). Проба проводится в приборе (рис. 25), состоящем из сосуда, в который кладут фильтр немного гранулированного цинка и разбавленной серной кислоты (оба вещества должны быть абсолютно чистыми, особенно без примеси As). Водород, возникающий в результате реакции, можно (убедившись, что весь воздух вытеснен) зажечь на конце трубочки (горит слабо-голубоватым пламенем). Потом в сосуд прибавляется через воронку испытуемый раствор (часть содержания желудка отравленного). Если в растворе присутствует соединение As, то под действием Н сейчас же образуется AsH3; пламя окрашивается в сизый цвет и из него идет белый дым As2О3; если же нагреть стеклянную трубочку, то за нагретым местом появится темное пятно ("мышьяковое зеркало"). Этим испытанием можно определить наличие и 0,05 мг As.
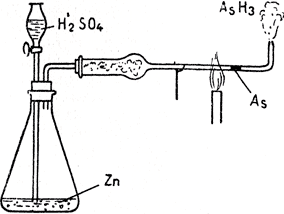
Рис. 25. Прибор Марша для установления присутствия мышьяка
Мышьяковистый ангидридAs2О3 образуется при обжиге металлических руд, содержащих хотя бы небольшое количество As. Пары, выделяющиеся при обжиге, отводятся в пылеосадительные камеры, где улавливается так наз. мышьяковый цвет, который очищается возгонкой. Мышьяк весьма ядовит. Важен как лекарство и как сырье для изготовления некоторых других лекарств. Служит также средством для сохранения мехов и кож. В стекольной промышленности применяется для очистки стекломассы и, наконец, для истребления мышей. As2О3 дает мышьяковистую кислоту, ее соли (мышьяковистокислые) арсениты. Путем окисления As2О3 переходит в As2O5, из которого получается мышьяковая кислота, H3AsО4, ее соли арсенаты. Из соединений мышьяка с серой наиболее важен As2S2, двусерный мышьяк, получаемый искусственно в виде краского мышьякового стекла, и As2S3, трехсернистый мышьяк, получаемый из мышьяковистого ангидрида в виде желтого мышьякового стекла. Оба соединения используются в дубильной промышленности и в пиротехнике. Все соединения мышьяка ядовиты.
Сурьма - промежуточное вещество между неметаллами и металлами. Среди ее нескольких разновидностей самая известная металлическая сурьма, ромбическая. Это белый, хрупкий, нетвердый металл с температурой плавления 630°С. В природе сурьма находится в виде сурьмяного блеска (антимонита), Sb2S3. Сурьма добывается обжигом и восстановлением полученного Sb2О3 углем. Использовать ее самостоятельно нельзя. Техническое значение имеют ее сплавы, а именно типографский сплав (Sb + Рb), подшипниковый сплав (Sb + Рb + Sn), белый металл и британский металл (Sb + Sn + Сu). Треххлористая сурьмаSbCl3 образуется прямым соединением Sb и Сl. Служит она для брунирования металлов, особенно железа и латуни. Из окисей сурьмы самые важные Sb2О3 и Sb2O5; из сульфидов определенное значение имеет Sb2S5, золотая сера, - оранжевый порошок, употребляемый в качестве ускорителя при вулканизации каучука. Соединения Sb тоже ядовиты.
Висмут - блестящий, с красноватым оттенком, очень хрупкий металл, с температурой плавления 286°С. При затвердевании сплав несколько растягивается (что существенно для стереотипии). В природе распространен как висмутовый блеск, Bi2S3, часто сопровождающий никелевую и кобальтовую руды. Используется как присадка в легкоплавких сплавах, напр. сплаве Розе (1 Sn + 1 Рb + 2 Bi) с температурой плавления 94°С, а также в сплавах для стереотипии (отливка гранок для типографских пластин). Легкоплавкие сплавы служат для изготовления предохранителей противопожарных аппаратов. Окись висмута, Bi2O3, - белый порошок. Служит для производства специальных стекол. Азотнокислый висмут, Bi(NO3)3 получается растворением Bi в HNO3. Это белое кристаллическое вещество, применяемое при изготовлении лекарств (дерматола, аирола, ксероформа).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'