
VI. Органическая химия
1. Основные понятия органической химии
а) Источники органических веществ
Органические вещества часто встречаются в природе, причем для получения таких веществ бывает достаточно выделить их из природного сырья (крахмал из картофеля, сахар из свеклы и т. д.). В других случаях за исходный материал берут сырье, полученное из естественного материала путем его переработки различными способами; напр. путем сухой перегонки каменного угля можно получить помимо светильного газа и аммиачной воды также каменноугольный деготь, из которого путем разгонки на фракции в свою очередь получают бензол, фенол, нафталин и т. д. Эти же вещества служат основным сырьем для производства огромного количества более сложных органических соединений (нитробензола, пикриновой и фталевой кислот и т. д.). Некоторые органические вещества получаются синтетически из веществ минерального происхождения; так напр. из кокса и извести в электрической печи получают карбид, из которого, разлагая его водой, производят ацетилен, служащий исходным продуктом для изготовления многих разнообразных органических веществ. Или из смеси СО и водорода путем воздействия известных катализаторов получают метиловый спирт - сырье для производства формальдегида, муравьиной кислоты и др.
б) Характеристика органических веществ
Для характеристики органических веществ устанавливаются, как правило, их некоторые физические свойства. У кристаллических веществ это, в частности, температура плавления (т. пл.), у жидкостей - температура кипения (т. кип.). Температура плавления дает нам возможность контролировать, с одной стороны, чистоту органических веществ (в большинстве случаев примеси понижают т. пл. влажность действует подобно примесям), с другой стороны, мы при ее помощи можем определить, с каким именно органическим веществом мы имеем дело (идентифицировать его). Другими часто устанавливаемыми физическими константами органических веществ являются плотность и коэффициент преломления. В последнее время органические вещества исследуются также спектральным анализом и рентгеновскими лучами.
в) Состав органических веществ и их эмпирические и молекулярные формулы.
Органические вещества состоят только из небольшого количества элементов. Каждое органическое вещество содержит углерод, большинство из них водород или еще и другие элементы, чаще всего кислород и азот, реже фосфор, серу или галогены. Особый вид органических веществ содержит также металлы.
Химическим анализом органического вещества (полным сжиганием органических веществ в кислороде) устанавливается процентное соотношение объемов элементов, из которых состоит вещество. Отношение количества атомов элементов, образующих данное соединение, определяется делением процентного содержания каждого элемента на его атомный вес. Так, напр., было установлено, что испытуемое вещество содержит 79,28% С, 10,5% Н, недостающие до ста процентов - 10,67% приходится на долю О. Эмпирическую формулу этого соединения CmHnOp устанавливаем пропорцией: 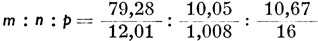 , где знаменателями будут атомные веса соответствующих элементов. Произведя действие деления, получаем пропорцию: m : n : р = 6,61 : 9,97 : 0,67; деля все члены правой стороны пропорции на меньший ее член, получаем: m : n : р = 9,26 : 14,95 : 1; затем, округляя полученные цифры, устанавливаем, что m : n : р - 10 : 15 : 1. Таким образом, эмпирическая формула соединения будет С10Н15О. Так как такой результат дали бы также соединения С20Н30О2, С30Н45О3 и т. д., то необходимо еще одним из соответствующих физических методов установить молекулярный вес соединения. В нашем" случае молекулярный вес соединения оказывается равным 302, так как молекулярный его вес определяется путем подсчета составляющих его атомных весов элементов; здесь: 20 * 12,01 + 30 * 1,008 + 2.16 = 302,23. Молекулярная формула соединения, следовательно, будет С20Н30О2.
, где знаменателями будут атомные веса соответствующих элементов. Произведя действие деления, получаем пропорцию: m : n : р = 6,61 : 9,97 : 0,67; деля все члены правой стороны пропорции на меньший ее член, получаем: m : n : р = 9,26 : 14,95 : 1; затем, округляя полученные цифры, устанавливаем, что m : n : р - 10 : 15 : 1. Таким образом, эмпирическая формула соединения будет С10Н15О. Так как такой результат дали бы также соединения С20Н30О2, С30Н45О3 и т. д., то необходимо еще одним из соответствующих физических методов установить молекулярный вес соединения. В нашем" случае молекулярный вес соединения оказывается равным 302, так как молекулярный его вес определяется путем подсчета составляющих его атомных весов элементов; здесь: 20 * 12,01 + 30 * 1,008 + 2.16 = 302,23. Молекулярная формула соединения, следовательно, будет С20Н30О2.
г) Изомерия. Структурные и электронные формулы органических соединений
Установлением молекулярной формулы еще не решается вопрос о том, с каким именно химическим соединением мы имеем дело. Опыт показывает, что одинаковую молекулярную формулу могут иметь два или более органических соединений различных физических и химических свойств. Так, напр., известны два вещества с молекулярной формулой С2Н6О. Одно из них жидкость с т. кип. 78,3°С (этанол), другое газ, переходящий в жидкость при - 23,6°С (диметилэфир). Разные соединения, обладающие одной и той же молекулярной формулой, называются по Берцелиусу изомерами, а самое это свойство называется изомерией (греч. изос - одинаковый, мерос - частица, т. е. вещества, состоящие из одинаковых частиц, атомов).
Явление изомерии объяснил руский химик А. М. Бутлеров (1826 - 1886) своей теорией строения органических соединений. По Бутлерову свойства органического соединения зависят от:
1. его химического состава (рода и количества атомов, составляющих его),
2. его структуры (конституции, строения), т. е. расположения связей, при помощи которых отдельные атомы соединяются в молекулы.
Письменным выражением структуры органического соединения является его структурная формула, в которой обозначены отдельные атомы и их взаимные связи. Изомеры - это вещества, имеющие одну и ту же молекулярную формулу, но разные структуры, а значит, и разные структурные формулы. В нашем случае первая структурная формула принадлежит этанолу, вторая - диметилэфиру:
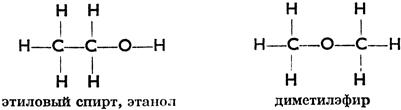
Структурные формулы предложил немецкий химик Ф. Кекуле (1829 - 1896).
Как было уже указано ранее, углерод не способен образовывать ионные связи, но зато отличается исключительной способностью образовывать ковалентные (атомные, химические) связи, т. е. связывать простыми, двойными и тройными связями не только атомы других элементов, но и атомы углерода. Этим углерод отличается от всех остальных элементов. Эта исключительная способность является причиной огромного количества органических соединений и находит отражение в их структурных формулах.
Наиболее простое органическое соединение - метан, СН4. В случае соединения этого углеводорода с хлором, при известных условиях, возникает согласно реакции: СН4 + Сl2 = СН3Сl + HCl вещество, называемое хлористым метилом. Из уравнения видно, что один атом водорода был замещен атомом хлора. Поэтому подобная реакция называется реакцией замещения. При известных условиях можно действием AgOH заместить хлор группой - ОН, причем образуется соединение СН3ОН (метиловый спирт). Эта формула напоминает формулу едкого натра, NaOH, однако между ними есть и существенная разница. NaOH является соединением ионным, в растворе диссоциирующимся на Na+ + ОН-, а в соединении СН3 - ОН группа - ОН присоединяется ковалентной связью. Поэтому растворы метилового спирта не реагируют как основания, но являются нейтральными. Если воспользуемся структурными формулами, то ход реакции может быть изображен следующим образом:
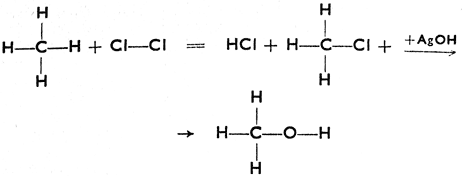
Вместо хлора в молекулу может войти также Вr или J. При действии на иодистый метил металлическим натрием образуется, согласно уравнению CH3J + 2 Na + JСН3 = СН3СН3 + 2 NaJ, углеводород этанС2Н6. Так же, как это было проделано с метаном, можно из этана образовать этиловый спирт, а из него при действии обезвоживающего реагента (концентрированной H2SO4) углеводород этилен С2Н4. Пользуясь структурными формулами, изобразим эти реакции так:
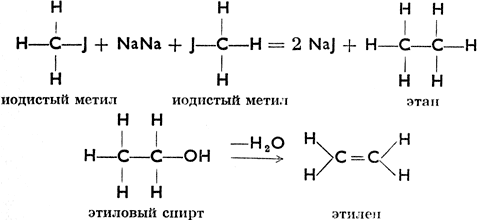
Этилен легко соединяется с бромом, образуя дибромистый этилен, С2Н4Вr2, который действием КОН теряет НВr и переходит в новый углеводород - ацетилен. Структурно это выразится так:
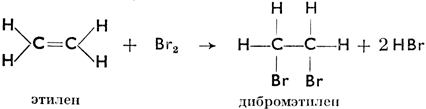
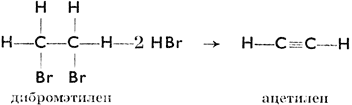
В структурной формуле этана связь между углеродными атомами простая, в формуле этилена - двойная, а в формуле ацетилена - тройная. Реакция этилена с бромом является примером реакции соединения, при которой из двух молекул возникает одна (их слиянием).
Если мы заменим в структурных формулах черточки, обозначающие связи, точками, символизирующими пары электронов, то получим электронные формулы органических соединений. Напр.
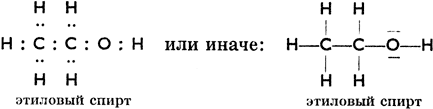
(свободные электронные пары обозначены черточками)

Изображение структурных формул отнимает, однако, много времени, и они занимают много места, а потому в тех случаях, когда ошибка невозможна, прибегают к так наз. рациональным формулам, т. е. упрощенным структурным формулам, которые пишутся различными способами. Иногда связи обозначаются черточками, иногда точками. В последнее время связи обозначаются только в том случае, если они помогают объяснению; в противном случае их вовсе не обозначают. При писании рациональных формул не надо забывать, что каждая углеродная группа пишется отдельно. Так, напр., пишем:
метиловый спирт СН3 - ОН или СН3 * ОН или СН3ОН
этан СН3 - СН3 или СН3 * СН3 или СН3СН3,
этиловый спирт СН3 - СН2 - ОН или СН3 * СН2 * ОН или СН3СН2ОН.
д) Полимерия
Химическая реакция, при которой из двух одинаковых молекул образуется двойная молекула, называется димеризацией и ее можно вообще выразить уравнением А + A = (А)2. Поэтому соединение А называется мономер, а соединение (А)2 димер. Точно так же известна тримеризация (тример) и т. д. Все эти реакции вообще называются полимеризацией. У неорганических соединений она встречается редко, у органических веществ очень часто. Так напр. бензол, С6Н6, представляет собой тример ацетилена, С2Н2. Димером ацетилена является винилацетилеи, С4Н4, причем ацетилен, С2Н2, здесь мономер.
Полимеры имеют ту же эмпирическую формулу, что и мономер (в данном случае СН), но различаются своим молекулярным весом, который всегда кратен молекулярному весу мономера.
О полимерах и полимеризации, как правило, говорится, когда мы имеем дело с естественными или искусственными веществами типа (А)n, где n представляет собой большое целое, зачастую неизвестное число. Примером могут служить крахмал и целлюлоза, натуральный или искусственный каучук и т. д.
е) Стереохимия. Шариковые и сферические модели молекул
Структурные формулы, писанные на плоскости (на бумаге), дают очень несовершенное представление о молекулах. Ведь нам известно, что молекулы трехмерны, и, следовательно, ковалентные связи действуют по известным направлениям. Впервые мысль о пространственной направленности углеродных связей была высказана почти одновременно французом Ж. Лe Белель (1847 - 1930) и голландцем Я. Вант-Гоффом (1852 - 1911), которые и стали таким образом основателями стереохимии, занимающейся пространственным строением молекул. Согласно их теории, простые связи углерода направлены к вершинам правильного тетраэдра (как у алмаза, и образуют между собой равные углы, каждый в 109°28'. Это их предположение было подтверждено физическими исследованиями, в результате которых была даже измерена длина отдельных связей.
Полное представление о положении в пространстве связей и о пространственном строении молекул дают модели молекул. На рис. 26 изображены шариковые модели молекул метана и этана, в которых черные шарики представляют атомы углерода, а белые - атомы водорода.
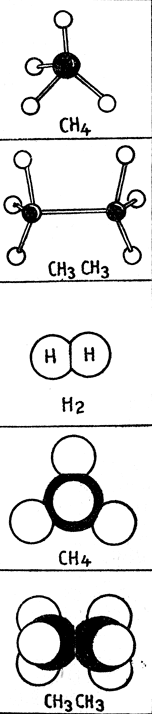
Рис. 26. Модели молекул
Еще гораздо более совершенны сферические модели, ибо контуры их точно ограничивают пространство, занимаемое молекулой. На рис. 26 изображены, например, сферические модели метана и этана. Модели молекул знакомят нас с пространственным строением молекул лишь в статическом их состоянии, т. е. в полном покое. На самом деле состояние покоя молекулам не свойственно, т. е. отдельные атомы совершают вращательные и колебательные движения.
ж) Классификация органических соединений
Естественным руководящим признаком при классификации органических соединений служит строение углеродного скелета. В соответствии с этим органические соединения подразделяются на:
I. Соединения ациклические (алифатические, класс жирных соединений), молекулы которых состоят из открытой, прямой или разветвленной цепи атомов углерода. Эти соединения могут быть насыщенными (все связи простые), или ненасыщенными (с двойными или тройными связями). Например:
-С-С-С-С-С-С. . . . . . . . . . . . . . .
прямая цепь с простыми связями
. . . . . . . .СН3СН2СН2СН2СН3
нормальный пентан
-С-С-С = С-. . . . . . . . . . . . . . . .
прямая цепь с двойной связью
. . . . . . . . . СН3СН2СН = СН2
1 - бутен
-С-С-С = С-. . . . . . . . . . . . . . . . . . . . . . .СН3СН2С≡СН
прямая цепь с тройной связью. . . . . . . . . . . бутин - 1
II. Соединения циклические, в молекуле которых находятся один или несколько замкнутых колец (циклов) атомов углерода. Они разделяются на:
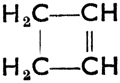
а) алициклические, насыщенные или ненасыщенные, с побочными цепями или без них. Напр.:
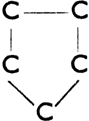
Пятичленное кольцо связи простые
Циклопентан
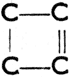
Четырехчленное кольцо с одной двойной связью
Циклобутен
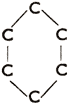
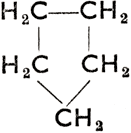
Шестичленное кольцо все связи простые
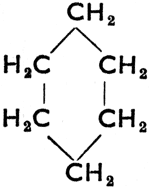
Циклогексан
б) ароматические, имеющие в молекуле одно или несколько шестичленных колец с тремя двойными связями (эти кольца называются бензольными ядрами). Напр.:
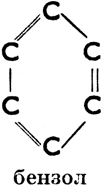
Бензол
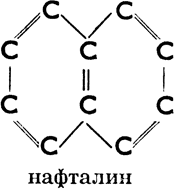
Нафталин
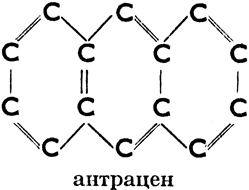
Антрацен
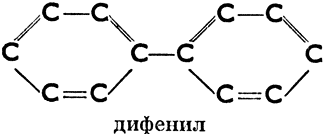
Дифенил
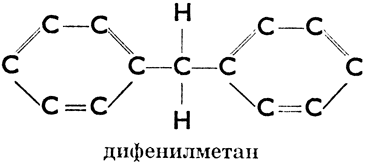
Дифенилметан
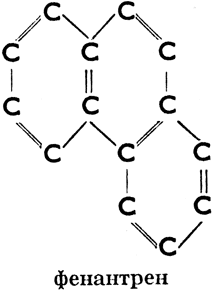
Фенантрен
III. Соединения гетероциклические, в молекулах которых углеродное кольцо в одном или нескольких местах прерывается атомами других элементов. Эти атомы (чаще всего это бывает S, N, О) мы называем гетероатомами. Примеры колец:
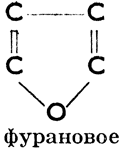
Фурановое
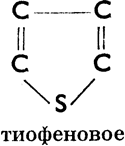
Тиофеновое
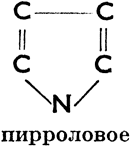
Пирроловое
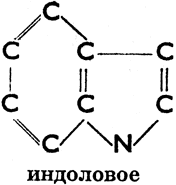
Индоловое
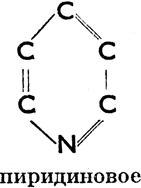
Пиридиновое
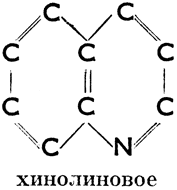
Хинолиновое
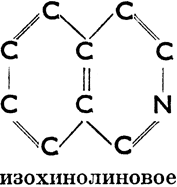
Изихинолиновое
з) Производные углеводородов. Функциональные группы
Из классификации органических соединений в зависимости от углеродного скелета вытекает, что большинство их является производными или дериватами углеводородов. Если мы заменим теоретически, т. е. на бумаге или мысленно, в каком-нибудь углеводороде один или несколько атомов водорода другими элементами (Cl, Br, J) или группами атомов (-ОН, -NH2, -NO2, -SN, -CN, -SО3H, -COOH и т. д.), называемыми иначе заместителями, то получим соединения, физические и химические свойства которых будут значительно отличаться от исходных углеводородов. Напр.:
CH4 (метан) → СH3Cl (хлористый метил) → СH3NH2 (метиламин) → CH3OH (метиловый спирт) → СH3CO2H (уксусная кислота)
СН3СН3 (этан) → СН3СН2Вr (бромистый этил) → CH3CH2CN (цианистый этил) → С6Н6 (бензол) → С6Н6NН2 (анилин) → C6H6SO3H (бензолсульфикислота)
Присутствие известных групп атомов ("заместителей") в молекуле соединения способствует тому, что это соединение функционирует в химическом отношении вполне определенным образом, а поэтому такие группы атомов называются функциональными группами.
Производные могут быть монотопическими, дитопическими, тритопическими и т. д., вообще политопическими, в зависимости от того, было ли замещение проведено в одной, двух или большем числе групп атомов. Напр.:
СН3СН2СН3 (пропан) → СН3СН2СН2Сl (монотопический) → СН3СНСlCH2Cl (дитопический) → СН2СlCHClCH2Cl (тритопический дериват)
Если мы в одной и той же группе атомов заменим элементами или группами атомов один, два, три или четыре атома водорода, то соответственно этому получим соединения с простым, двойным, тройным или четверным замещением. Напр.:
CH4 (метан) СH3Cl (простое замещение (монохлористый метан)) СН2Сl2 (двойное(двухлористый метан) СНСl3 (тройное (трихлорметан)) ССl4 (четверное (тетрахлорметан))
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'