
2. Углеводороды
Углеводороды - соединения углерода с водородом. Нам известно огромное их множество (вследствие чрезвычайной способности атомов углерода образовывать цепи), причем наиболее простым углеводородом является метан, СН4. Подобно всем органическим соединениям классификация углеводородов осуществляется на основе углеродного скелета.
а) Парафины (алканы)
Парафины характеризуются тем, что их молекулы состоят из прямой или разветвленной цепи углеродных атомов, соединенных простыми связями. Парафины, следовательно, насыщенные углеводороды, а т. к. первый их член - метан, то их еще называют углеводородами метанового ряда.
Их рациональные формулы производим от СН4 таким образом, что последовательно замещаем по одному водороду группой -СН3, обладающей одной связью (радикалом метилом). Получаем при этом ряд, приведенный в табл. 15.
Таблица 15
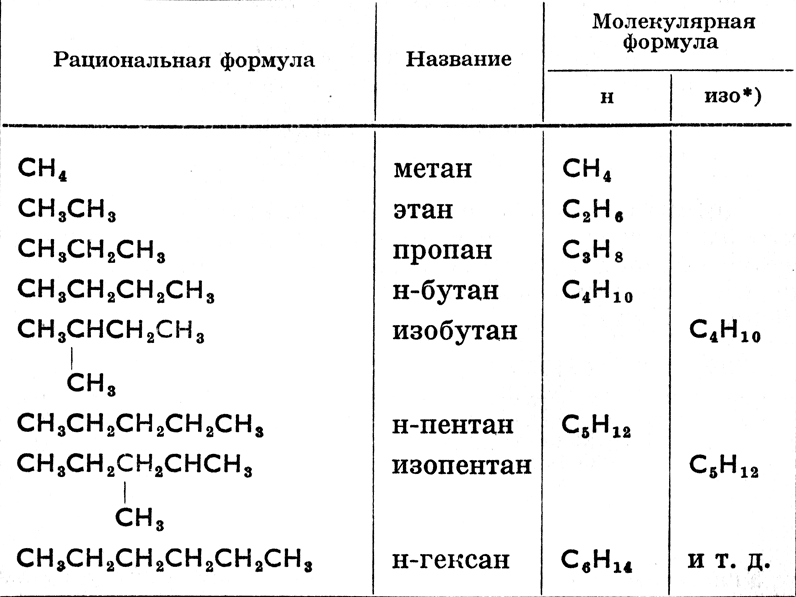
*(Изомеры, т. к. у них может быть замещен первый или какой-нибудь другой водород. Обозначаем их префиксом "изо", нормальные же углеводороды буквой "н".)
Общая формула парафинов CnH2n+2, где n есть целое число. Отнимая от парафинов по одному атому водорода, получаем односвязные группы общей формулы CnH2n+1, так наз. алкилы, напр., -СН3 метил, -СН3СН2 (или -С2Н5) этил, -СН3СН2СН2 (или -С3Н7) пропил, -СН3СН2СН2СН2 (или -С4Н9) бутил, -С5Н11 амил, -С6Н13 гексил и т. д. Односвязные группы называются также органическими радикалами. Радикалы, как правило, не изменяются при химических реакциях (подобно элементам, что дало некогда повод предложить для органической химии название "химия радикалов"), а при освобождении тотчас же образуют новое соединение.
От слова "алкил" произошло также, согласно женевской номенклатуре органических соединений (установленной на международном съезде химиков в Женеве в 1892 году), название парафинов "алканы". Основное правило женевской номенклатуры требует, чтобы зная международное название соединения, можно было написать его формулу и, наоборот, на основании структурной формулы можно было узнать название соединения. Так напр. женевские названия более сложных парафинов произведены от n-углеводородов, углеродные атомы которых перенумерованы, как правило, справа налево следующим образом:
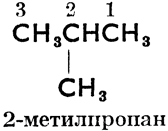
2-метилпропан
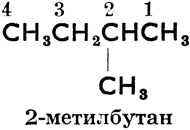
2-метилбутан
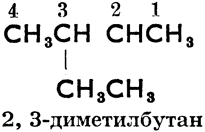
2, 3-диметилбутан
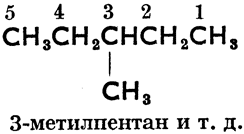
3-метилпентан
Углеводороды метанового ряда - это вещества довольно устойчивые, нереактивные. Они разлагаются только при действии высоких температур, причем из парафинов с большим молекулярным весом получаются углеводороды с более короткой цепью. Подобные реакции называются пирореакциями и имеют большое значение при так наз. крекинге нефти.
Метан, этан, пропан и бутан при нормальных условиях газы (они находятся в природном и светильном газах Ц в крекинггазе), последующие члены ряда от С5 до С15 - жидкости (их смесь образует бензин, керосин и минеральные масла, получающиеся при фракционированной перегонке нефти). В нефти находятся также и углеводороды с высшим содержанием С, являющиеся твердыми телами (основная часть продажного парафина). Все парафины горючи и удельный их вес ниже единицы.
Некоторые высшие парафины получаются путем синтетической реакции, открытой французским химиком Ш. А. Вюрцем (1817 - 1894). Напр.:
2 СН3СН2СН2СН2Вr + 2 Na = 2 NaBr + CH3CH2CH2CH2CH2CH2CH2CH3
н-бромистый бутил н-октан
Как видно из таблицы парафинов, они образуют ряд, в котором разница в составе соседних членов одинакова, а именно СН2 (гомологическое приращение). Подобные ряды называются гомологическими, способность же органических соединений образовывать такие ряды - гомологией. Отдельные члены гомологического ряда - гомологи (так напр., пентан является высшим гомологом бутана и низшим гексана); их химические свойства подобны между собой.
б) Циклопарафины
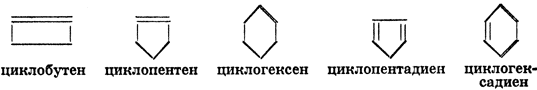
Циклопарафины - насыщенные углеводороды, в молекулах которых имеется замкнутое кольцо из углеродных атомов. Они образуют гомологический ряд по общей формуле СnН2n, в котором первым членом является циклопропан, С3Н6, т. к. для образования кольца необходимо наличие по крайней мере трех атомов углерода. Структурные формулы некоторых членов этого ряда следующие:
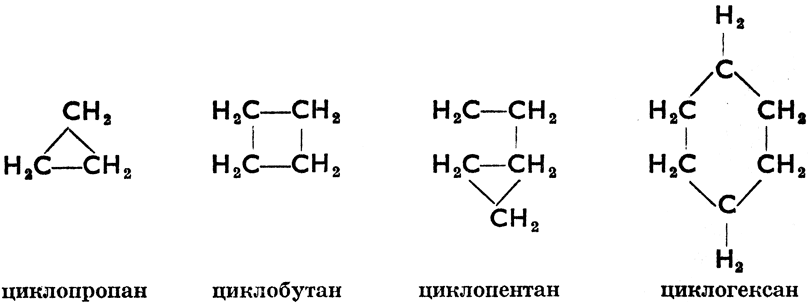
Некоторые циклопарафины находятся в кавказской нефти и называются нафтенами.* Циклогексан можно получить методом каталитической гидрогенизации (действием водорода при высокой температуре в присутствии катализатора, чаще всего тонкорассеянного никеля) из бензина, согласно схеме
*(Примечание переводчика. Нафтенами в русской литературе называются все циклопарафины.)
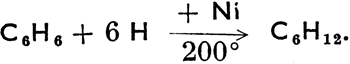
Некоторые циклопарафины образуют несколько колец. Мы называем их полициклическими (би-, трициклическими и т. д.). Для того, чтобы и из их молекулярных формул было ясно, что речь bдет о циклических соединениях, к ним приписывается буква R, а у соединений с двумя кольцами 2 R. Точно так же двойную связь обозначаем знаком =, две двойных связи 2 =, тройную связь = и т. д. Из полициклических парафинов особенно важен декалин, известный растворитель. Он получается путем каталитической гидрогенизации нафталина, поэтому иначе и называется декагидронафталин. Эта реакция пробегает по следующей схеме:
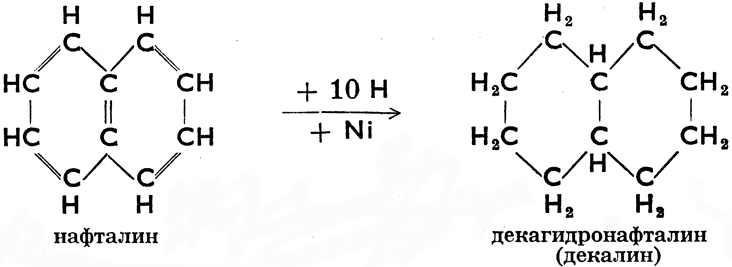
Выписывать все углеродные и водородные атомы в формулах органических соединений слишком долго, поэтому принято пользоваться упрощенными формулами, в которых кольца обозначаются многоугольниками. При этом следует обозначать двойные связи. Вышеприведенная схема, таким образом, пишется так:
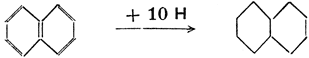
в) Олефины (алкены)
Олефины - ненасыщенные углеводороды, имеющие в молекуле одну или несколько двойных связей. В зависимости от степени ненасыщенности различаем: моноолефины с общей формулой CnH2n1 F, диолефины (диены) СnН2n-22 F, триолефины, CnH2n-43 F и т. д. Так называемые циклоолефины - это ненасыщенные углеводы с углеродным кольцом в молекуле. Примеры: Моноолефины: СН2 = СН2 этен (этилен), СН3СН = СН2 пропен (пропилен), 4СН33СН22СН2 = 1СН2 бутен-1, 4CH33CN = 2CH1СН3 бутен-2 (цифра вслед за названием показывает положение двойной связи, т. е. от какого углерода она исходит). Диолефины: СН2 = С = СН2 пропадиен (аллен), 4СН2 = 3СН - 2СН = 1СН2 бутадиен-1, 3, 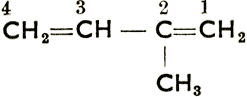 2-метилбутадиен-1, 3 (изопрен, цифра перед названием обозначает положение метила).
2-метилбутадиен-1, 3 (изопрен, цифра перед названием обозначает положение метила).
Циклоолефины:
Если молекула органического соединения содержит две двойных связи, то для его физических и химических свойств важно взаимное положение связи, в зависимости от которого различаем двойные связи кумулированные, С=С=С, конъюгированные, С=С-С=С, и изолориванныеC=C-C-C=C.
Некоторые моноолефины содержатся в природном и в крекинггазе, откуда их и добывают. Можно их получить и методом дегидратации, т. е. отщеплением воды от спиртов, напр. СН3СН2ОН → СН2 = СН2 + Н2О. Обыкновенно речь идет о каталитической дегидратации, т. е. пары спирта пропускаются через Аl2О3 при 350 - 400°С.
Этен, пропен и бутен-1 газы, средние моноолефины - жидкости, а высшие - твердые вещества. Химические свойства олефинов связаны с наличием двойной связи (это термин неподходящий, ибо двойная связь не крепче простой, а как раз наоборот), ибо ненасыщенное соединение подвергается воздействию различных химических процессов, именно на углеродные атомы, соединенные двойной связью. Вот наиболее известные химические реакции ненасыщенных углеводородов:
Каталитическая гидрогенизация:
СН3СН = СН2 + Н2 = СН3СН2СН3 (пропан)
Присоединение галогенов:
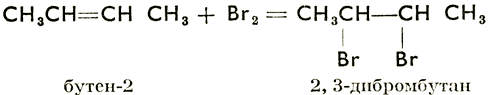
Этой реакцией доказывается наличие двойной или тройной связи, т. е. ненасыщенность органических соединений. Испытуемое вещество прибавляется к раствору Вг в хлороформе. Если вещество не насыщено, то раствор брома обесцветится.
Присоединение водородных соединений галогенов:
СН2 = СН2 + HJ = СН3СН2J (иодистый этил).
Реакция присоединения HCl протекает только в присутствии соответствующих катализаторов.
Гидратация (присоединение воды):
СН2 = СН2 + Н2О = СН3СН2ОН
может быть осуществлена лишь в случае пропускания смеси этилена и водяных паров при 225°С через подходящий катализатор.
Окисление при двойной связи:
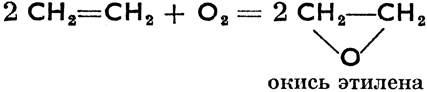
Окисляющий фактор в данном случае кислород воздуха, а катализатор - серебро. Двойную связь можно разрушить также действуя окислителями, на чем основано предложенное А. Байером испытание ненасыщенных органических соединений раствором КМnO4, который под их воздействием обесцвечивается. Особое значение имеет окисление озоном, так наз. озонирование.
Из сказанного видно, что двойная связь намного реактивнее простой; это проявляется в разнообразнейших химических реакциях, которые обыкновенно с насыщенными соединениями не удаются, или могут проводиться лишь при исключительных условиях.
Технически важная реакция - это полимеризация олефинов. С помощью этой реакции, напр., этилен переходит в полиэтилен:
. . . СН2 = СН2 + СН2 = СН2 + СН2 = СН2 . . . . → (-СН2-СH2-CH2-CH2-CН2-СН2-)
Эта реакция лежит в основании производства некоторых пластических масс и полимеризации бутадиена:
n СН2 = СН-СН = СН2 → (СН2 = СН-СН = СН2)n,
полимер которого служит исходным продуктом для получения синтетического каучука, тогда как натуральный каучук является полимером изопрена (С5Н8)n, где n неизвестное число.
г) Ацетилены (алкины)
Ацетилены - ненасыщенные углеводороды, в молекуле которых налицо по крайней мере одна тройная связь. Они образуют гомологический ряд СnН2n-2 ≡. Наиболее известны из них: СН ≡ СН ацетилен (этин), СН3С ≡ СН пропин (метилацетилен), СН3СН2С ≡ СН бутин-1, СН3С ≡ ССН3 бутин-2 и т. д. Ацетилены весьма реактивны; причина этого их свойства - наличие тройной связи. Вот их наиболее известные реакции:
Гидрогенизация (присоединение водорода);
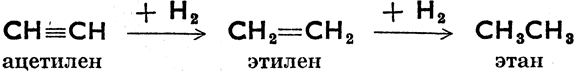
Присоединение хлора:

Присоединение водородных соединений галогенов:
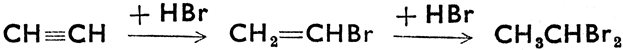
Гидратация:
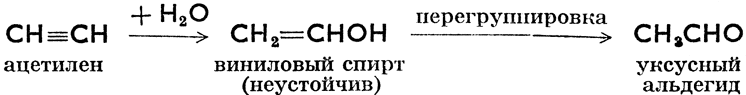
Эта последняя реакция, открытая русским химиком М. Г. Кучеровым (1850 - 1911), проходит в присутствии соли Mg2+ и лежит в основе изготовления уксусной кислоты и спирта из ацетилена.
Ацетилиды возникают действием ацетиленов на аммиачные растворы гидроокисей меди и серебра: СН ≡ ССu и CH ≡ CAg; это взрывчатые вещества.
Полимеризация. Димер ацетилена называется винилацетиленом. Он образуется по схеме: СН ≡ СН + СН ≡ СН → СН2 = СН - С ≡ СН и служит исходным продуктом для изготовления хлоропренового каучука. Тример ацетилена - ароматический углеводород бензол, С6Н6, получаемый по схеме: 3 СН ≡ СН → С6Н6 при высокой температуре и в присутствии катализаторов. Это реакция огромного значения, ибо бензол чрезвычайно важное сырье для изготовления красителей.
Чистый ацетилен - газ, получаемый из карбида. Ацетилено-воздушное пламя дает яркий свет. Но теперь ацетилен применяется главным образом для автогенной сварки и в качестве сырья для получения различнейших органических соединений.
д) Ароматические углеводороды (бензольный ряд)
В молекуле ароматических углеводородов имеется одно или несколько бензольных ядер. Название "ароматические", которое распространяется и на производные этих углеводородов, возникло вследствие того, что первые известные вещества этой группы обладали запахом (ароматом). Ниже приводятся формулы и свойства наиболее важных ароматических углеводородов:
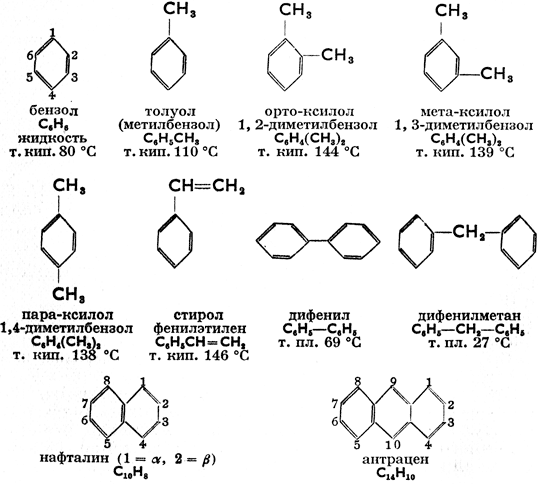
Бензол - бесцветная жидкость приятного запаха в высшей степени горючая и ядовитая. Известен как растворитель и является важным сырьем в промышленности синтетических ароматических соединений. Толуол, - С6Н5СН3 (метил бензол или фенилметан: односвязная группа С6Н5 называется фенил; вообще же название радикалов - остатков ароматических углеводородов - арилы), имеет те же свойства горючего, что и бензол, и используется подобно ему. Ксилолы (диметилбензолы) - бесцветные жидкости, изомеры, в структурных формулах которых есть метиловые группы, занимающие положение: 1,2 = орто, 1,3 = мета или 1,4 = пара (сокращенно: о-, m-, р-). Стирол (фенилэтилен) - бесцветная жидкость с т. кип. 146°С. Производится путем дегидрогенизации этилбензола, а при полимеризации дает полистиролmные пластмассы. Нафталин образует чешуйчатые кристаллы жемчужного цвета с т. пл. 80°С. Служит сырьем для производства индиго и фталевой кислоты. Действием водорода гидрогенизируется в тетралин, при более сильной гидрогенизации - в декалин по схеме: 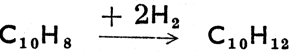 (тетралин)
(тетралин) 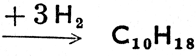 декалин, известные растворители. Антрацен, С14H10, образует бесцветные кристаллы с т. пл. 219°С. Подобно нафталину содержит конденсированные (связанные общими атомами углерода) бензольные ядра. Примерами многоядерных ароматических углеводородов со свободными ядрами являются дифенилС6Н6 - С6Н5 (фенилбензол) и дифенилметан, С6Н5 - СН2 - С6Н5. Все ароматические углеводороды ядовиты, многие из них карцерогенны, т. е. обладают способностью вызывать раковые заболевания.
декалин, известные растворители. Антрацен, С14H10, образует бесцветные кристаллы с т. пл. 219°С. Подобно нафталину содержит конденсированные (связанные общими атомами углерода) бензольные ядра. Примерами многоядерных ароматических углеводородов со свободными ядрами являются дифенилС6Н6 - С6Н5 (фенилбензол) и дифенилметан, С6Н5 - СН2 - С6Н5. Все ароматические углеводороды ядовиты, многие из них карцерогенны, т. е. обладают способностью вызывать раковые заболевания.
Большинство ароматических углеводородов производится в больших количествах путем фрационированной перегонки каменноугольного дегтя; некоторые, кроме того, путем алкилирования более простых ароматических углеводородов.
В соответствии со структурой ароматические углеводороды должны были бы, имея три двойных связи в ядре, обладать ярко выраженными свойствами ненасыщенных соединений. На самом же деле двойные связи теряют в бензольном ядре свой ненасыщенный характер. Об этом свидетельствует тот факт, что реакции соединения протекают у них лишь при особых условиях. Так напр. они гидрогенизируются в присутствии катализаторов (см. выше о гидрогенизации нафталина). Под действием солнечных лучей бензол дает с хлором соединение С6Н6Сl6 (гексахлорциклогексан). Много легче ароматические углеводороды вступают в реакцию замещения. Напр.:
Галогенизирование:
C6H6 + Вr2 = С6Н5Вr + НВr
бензол бромбеизол
Нитрование:
С6Н6 + HNO3 = C6H5NO2 + H2O
бензол нитробензол
Сульфирование:
С6Н6 + H2SO4 = C6H5SO3H + Н2O
бензол бензолсульфоновая кислота
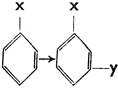
Особое значение имеет вопрос, какое положение займет новый заместитель. Подробными исследованиями было установлено, что заместители могут быть разделены на две группы:
I. группа заместителей направляет следующего заместителя в положение орто и пара,
II. группа заместителей направляет следующего заместителя преимущественно в положение мета. Схематически это можно изобразить так:
X в I группе:
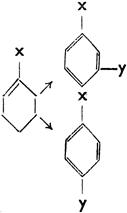
- NH2 аминогруппа
- ОН гидроксил
- СH3 метил (алкилы)
- Cl, - Вr, - J галогены (связи в группе простые)
X в II группе:
- NO2 нитрогруппа
- SO3H сульфогруппа
- СO2Н карбоксил
- СНО альдегидная группа
- CN циановая группа (связанный с ядром атом группы присоединен к другому кратной связью)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'