
3. Обзор важнейших органических соединений
а) Галогенопроизводные (галогениды)
Галогеновые производные углеводородов теоретически образуются из углеводородов замещением атомов водорода галогенами, получают же их или из углеводорода путем галогенирования, или из спиртов действием водородных соединений галогенов или хлоридов фосфора. Из их химических свойств важнейшими являются их способность к гидролизу (действием водяного пара под давлением или растворов щелочей), в результате которого получаются спирты, альдегиды, кетоны и карбоновые кислоты, как это показывают следующие примеры:
CH3CH2CH2CH2CH2Cl + H2O = CH3CH2CH2CH2CH2OH + HCl
I-хлорпентан пентанол I-(н-амиловый спирт)
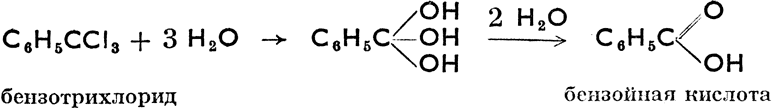
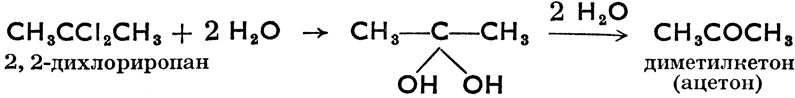
Путем разложения дигалогенпроизводных и тригалогенпроизводных должны были бы образоваться дигидрокси- производные и тригидроксипроизводные, но эти соединения неустойчивы (в момент возникновения теряют воду) и тотчас же переходят в альдегиды, кетоны или органические кислоты. Например:
С6Н5СН2Сl + Н2О
бензилхлорид
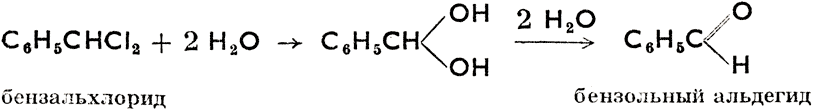
Из приведенных схем видно, что спирты характеризуются функциональной группой 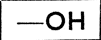 (поскольку она связана в цепи с углеродом), альдегиды группою
(поскольку она связана в цепи с углеродом), альдегиды группою 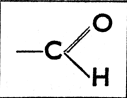 кетоны
кетоны 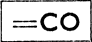 а карбоновые кислоты
а карбоновые кислоты 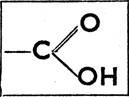 (карбоксил).
(карбоксил).
Реакции Вюрца подобна реакция Фиттига:
С6Н5Br(бромбензол) + 2 Na + BrCH2CH3 (бромистый этил) = 2 NaBr + C6H5CH2CH3 (этилбензол),
с ее помощью можно получить более сложные ароматические углеводороды. В присутствии безводного АlСl3 галогениды вступают в реакцию с простыми ароматическими углеводородами, причем получаются углеводороды более сложные. В честь открывших ее химиков она называется реакцией Фриделя-Крафтса. Например:
С6Н6 + СН3СН2Сl → С6Н5СН2СН3 (этилбензол) + НСl
С6Н6 + С6Н5СН2Сl → С6Н5СН2С6Н5 (дифенилметан) + НСl
В результате реакции металлического магния с галогенидами (в атмосфере безводного эфира) получается реактив, открытый французским химиком Виктором Гриньяром (1871 - 1935). Реакция проходит по схеме: CH3J + Mg + CH3MgJ (метилмагнезиумиодид). Реактивы Гриньяра имеют большое значение в современном синтезе.
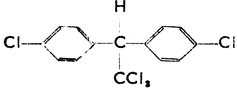
Хлористый метил, CH3Cl (т. кип. -23,7°С), бромистый метил, СН3Вr (т. кип. 4,6°С) и иодистый метил (т. кип. 42,6°С) применяются для введения -СН3 в органические соединения (метилирование). Фреон, CF2Cl2 (дифтордихлорметан), неядовитый, негорючий, лишенный запаха газ, применяется в холодильной технике как хладагент. Хлористый этил, СН3СН2Сl, замораживающее средство, служащее для временного лишения тканей чувствительности при легких операциях. Хлороформ, СНСl3 (трихлорметан) - жидкость сладковатого запаха. В медицине применяется как наркотическое средство. Йодоформ, CHJ3 (трииодметан), желтый порошок с запахом шафрана. В медицине употребляется для дезинфекции ран. Углекислый хлорид, ССl4 (тетрахлорметан) - бесцветная жидкость с т. кип. 76,8°С. Служит негорючим заменителем бензина. Трихлорэтилен, CHCl = ССl2 - жидкость с т. кип. 87°С. Негорючий и неядовитый растворитель. Хлористый винил, СН2 = CHCl, и винилиденхлорид, СН2 = ССl2, при их полимеризации дают пластмассы (полихлорвинил). Глоболь, С6Н4Сl2 (п-дихлорбензол) - бесцветные кристаллики, употребляющиеся как средство против моли. Хлористый бензил, С6Н5СН2Сl, хлористый бензал, С6Н5СНСl2, и бензотрихлорид, С6Н5ССl3, получаются при хлорировании толуола без катализаторов. Это слезоточивые жидкости. ДДТ (дихлордифенилтрихлорметилметан) - известный инсектицид. Его структурная формула:
б) Сульфоновые кислоты
Сульфоновые кислоты или сульфокислоты - соединения, имеющие в молекуле группу -SO3H, которую атом серы связывает ковалентной связью с атомом углерода. Получается при действии концентрированной H2SO4 на углеводороды (сульфирование). В жирном ряде сульфирование проходит с большим трудом. Ароматические углеводороды сульфируются очень легко. Так как сульфирование - реакция обратная, то следует концентрированную H2SO4 вводить с избытком. Напр. C6H6 + H2SO4 = C6H6SO3H + H2O. Соли сульфокислот - сульфонаты - легко кристаллизуются и поэтому их применяют для очищения сульфокислот, напр., C6H5SO3Na, бензолсульфонат натрия. Если в формуле сульфокислоты заместим группу -ОН хлором, то получим:
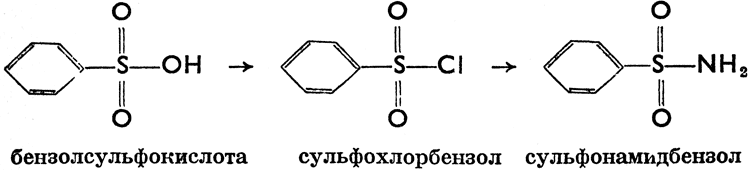
сульфохлориды, которые образуются при действии хлорсульфоновой кислоты на углеводороды. Если заменим группу -ОН группой -NH2, ТО образуются сульфаниламиды (соединения, имеющие важное значение в медицине). Важнейшая реакция сульфокислот - сплавление их солей с гидроксидами щелочей. Например:
С6Н5SO3Na (бензолсульфонат) + NaOH → Na2SO3 + C6H5OH (фенол)
Эта реакция является основной при синтетическом производстве фенола.
в) Нитросоединения
Нитросоединениями называются органические соединения, имеющие в молекуле одну или несколько групп -NO2, азот которых ковалентно связан с атомом углерода. Их получают действием концентрированной HNО3 в присутствии концентрированной H2SО4 (так наз. нитрующая смесь) на углеводороды. Алифатические углеводороды лучше всего нитруются в газообразном состоянии. Нитрование ароматических углеводородов нитрующей смесью не представляет особых затруднений. В зависимости от условий, при которых осуществляется реакция (состав нитрующей смеси и температура), получаются мононитропроизводные ди-, три- и т. д., вообще полинитропроизводные. Так напр. при нитровании бензола сначала получается C6H5NО2, мононитробензол, который при дальнейшем нитровании (с повышением температуры) переходит в м-динитробензол, C6H4(NО2)2, ибо -NO2 ставит новое производное в металоположение. При дальнейшем нагревании этого соединения с нитрующей смесью получается C6H3(NО2)3, 1,2,3-тринитробензол. Гомологи бензола нитруются легче бензола. При нитровании толуола сначала получаем C6H4CH3NО2 о- и р-нитротолуол (-СН3 направляет новое производное в орто- и параположения). Продолжая нитрование, получаем главным образом C6H2CH3(NО2)3. 2,4,6-тринитротолуол и помимо этого небольшое количество других изомеров.
Нитрование - одна из наиболее часто проводимых реакций не только в лабораториях, но и в техническом производстве. Из химических реакций нитросоединений особенно большое значение имеет их восстановление, посредством которого русский химик Николай Николаевич Зинин (1812 - 1880) впервые получил из нитробензола анилин, исходный продукт производства красителей.
Сейчас анилин производят, восстанавливая бензол водородом в момент его образования (в новейшее время электрохимически) по схеме: C6H5NО2 (нитробензол) + 6 Н → C6H5NH2 (анилин, аминобензол, фениламин) + 2 Н2О. При восстановлении в кислой среде образуется ряд промежуточных продуктов, которые, однако, не удается выделить. При восстановлении в основной среде побочные реакции проходят по схемам:
В кислой среде:
C6H5NO2 (нитробензол) → С6Н5NO (нитробензол) → С6Н5NН ОН (фенилгидроксиламин) → С6Н5NН2 (анилин)
В основной среде:
С6Н5NО + С6Н5NН ОН → С6Н5 - N = 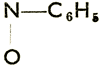 (азоксибензол) → С6Н5N (азобензол) = N C6H5 → C6H5NH - NH C6H5 (гидразобензол)→ 2 С6Н5NН2 (анилин)
(азоксибензол) → С6Н5N (азобензол) = N C6H5 → C6H5NH - NH C6H5 (гидразобензол)→ 2 С6Н5NН2 (анилин)
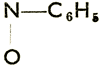 (азоксибензол) → С6Н5N (азобензол) = N C6H5 → C6H5NH - NH C6H5 (гидразобензол)→ 2 С6Н5NН2 (анилин)
(азоксибензол) → С6Н5N (азобензол) = N C6H5 → C6H5NH - NH C6H5 (гидразобензол)→ 2 С6Н5NН2 (анилин)Все промежуточные продукты можно получить также непосредственно.
Тетранитрометан, C(NО2)4, получают при действии HNO3 на ангидрид уксусной кислоты. Это одно из наиболее мощных взрывчатых веществ. Нитробензол, C6H5NO2 - бледно-желтая жидкость с т. кип. 206°С. Имеет неприятный запах горького миндаля (Мирбаново масло, суррогат горько-миндального масла). Применяется для отдушки мастики и как сырье при производстве анилина. Тринитротолуол, C6H2(NО2)3CH3 - известное взрывчатое вещество для снаряжения артиллерийских снарядов (TNT, тритол).
г) Амины
Амины получаются из аммиака, NH3, путем последовательного замещения водородных атомов алкилами или арилами. Напр. CH3NH2, метиламин (первичный); - C6H5NH2, анилин, фениламин (первичный); (C6H5)2NH, дифениламин (вторичный); (C5H6)3N, трифениламин (третичный). Таким образом, первичные амины характеризуются группой -NH2, вторичные = NH и третичные ≡N. Амины производятся путем восстановления нитросоеди- нений. Характер их основной, и с кислотами они образуют соли (подобно аммиаку), - напр. C6H5NH2 * HCl, гидрохлорид анилина, (C6H5NH2)2. H2SО4, сернистый анилин, - хорошо кристаллизирующиеся и растворяющиеся в воде. С органическими кислотами амины образуют так наз. анилиды, напр. C6H5NH2 + СН3СО2Н = C6H5 NH СОСН3 (ацетанилид). Наиболее важная в промышленном отношении реакция аминов - их диазотирование, т. е. реакция с азотистой кислотой по уравнению:
C6H5NH2 * НСl (анилингидрохлорид) + NaNO2 (азотистая кислота) + НСl = [C6H5N = N]+Cl- + NaCl + 2 H2O (хлористый бензилдиазоний (диазосоль))
Так как соли диазония в сухом состоянии взрывчаты, то их обыкновенно, немедленно, разными способами обрабатывают дальше.
Напр.:
а) [C6H5N = N]+Cl- (хлористый бензилдиазоний) → [C6H5NH NH2] (гидрохлорид фенилгидразина) * HCl → C6H5NH NH2 (фенилгидразин)
б) [C6H5N = N]+Cl- + H2O → C6H5OH (фенол) + N2 + HCl
в) [C6H5ΟN = N]+Cl- + (CuCl, CuCN) → C6H5Cl (реакция Зандмейера)
г)
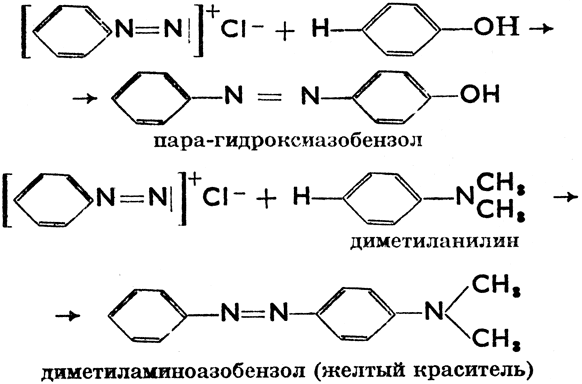
Эти и подобные реакции (их много, ибо разные диазоамины можно комбинировать с разными фенолами) называются азосочетаниями. Они составляют основу производства искусственных (анилиновых) красителей.
Метиламин, CH3NH3, газ с запахом аммиака. Диметиламин, (CH3)2NH, и триметиламин (CH3)3N, образуются при гниении белков и издают неприятный запах испорченной рыбы. Анилин, C6H5NH2, бесцветная жидкость, буреющая на воздухе, с т. кип. 184°С. Ядовит (разрушает элементы крови), используется как исходный материал в производстве красителей и лекарств. Толуидины, C6H4CH3NH2 (о-, m- и р-), и ксилидины, C6H3(CH3)2NH2, применяются в красильной промышленности. Дифениламин, C6H5NH С6Н5, кристаллическое вещество с т. пл. 55°С. Известен как реактив для определения NO-3 и NO-2.
Фенилендиамины, C6H4(NH2)2, могут быть о-, m- и р- (С6Н4 = это обладающий двойной связью радикал фенилен). Применяются в качестве проявителей в фотографии и красителя для меха. Сульфаниловая кислота, - C6H4NH2SO3H (1, 4), пара-аминобензолсульфоновая кислота, получается путем нагрева сульфата анилина до 200°С. Это - бесцветные кристаллы, употребляемые в производстве красителей (ее можно диазотировать). Нафтиламины, C10H7NH2, получаются восстановлением α- и β-нитронафталина.
д) Спирты
Спирты и фенолы - гидроксильные производные углеводородов, получаются путем замещения атомов водорода функциональной группой -ОН. У спиртов группа эта связана с атомом углерода, не являющегося членом ядра; у фенолов - непосредственно с углеродом ядра. Таким образом СН3ОН - гидроксиметан, метиловый спирт (в женевской номенклатуре метанол), СН3СН2ОН - этиловый спирт, этанол, С6Н5СН2ОН - бензиловый спирт, С6Н5ОН - фенол, С10Н7ОН - нафтол (фенол) и т. д. Группа -ОН является таким образом функциональной группой как спиртов, так и фенолов. В зависимости от числа в молекуле групп -ОН различают спирты и фенолы одноатомные, двухатомные, трехатомные и т. д. По положению гидроксильной группы -ОН спирты делятся на первичные, вторичные и третичные.
Напр.:

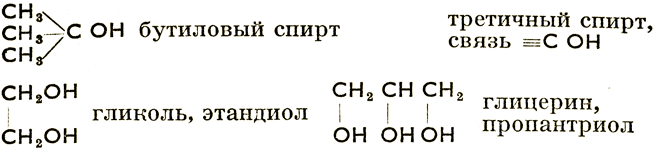
Спирты - бесцветные жидкости, высшие спирты - твердые вещества.
Щелочные металлы вытесняют водород гидроксильной группы с образованием алкоголятов: 2 СН3ОН + 2 Na = 2 CH3ONa + Н2.
При пропускании паров первичного или вторичного спирта через соответствующий катализатор происходит дегидрогенизация:
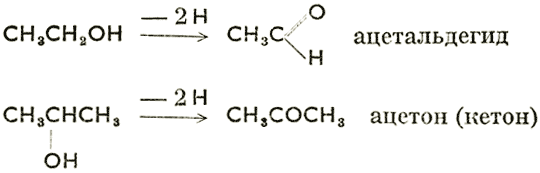
т. е. первичные спирты превращаются в альдегиды, а вторичные в кетоны. Эту же реакцию можно провести путем окисления (кислород отнимает водород в форме Н2О). Обратной реакцией, т. е. восстановлением или гидрогенизацией, можно из альдегидов получать первичные спирты, а из кетонов вторичные спирты. При дальнейшем окислении альдегидов образуются карбоновые кислоты по схеме: 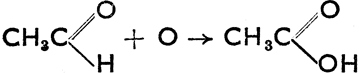 . Из вышеприведенного следует, что альдегиды характеризуются функциональной группой
. Из вышеприведенного следует, что альдегиды характеризуются функциональной группой 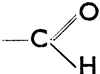 (сокращено: - СНО), кетоны =СО, карбоновые кислоты
(сокращено: - СНО), кетоны =СО, карбоновые кислоты 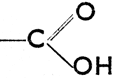 (сокращено: -СО2Н, карбоксил).
(сокращено: -СО2Н, карбоксил).
С минеральными кислотами спирты дают минеральные сложные эфиры. Важнейшие из этих соединений: диметилсульфат, CH3O-SO2-ОСН3, и нитроглицерин, получаемый согласно схеме:
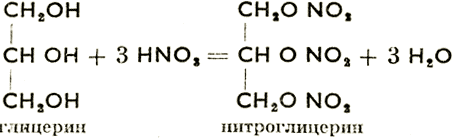
При нитровании глицерина температуру нельзя поднимать выше 30°С, т. к. нитроглицерин сильнейшее взрывчатое вещество. Это бесцветная ядовитая жидкость (применяется в медицине при сердечных заболеваниях и в технике при производстве динамита).
Метиловый, иначе древесный спирт, СН3ОН (метанол, карбинол), бесцветная, горючая и ядовитая жидкость с т. кип. 64,7°С. Получается при сухой перегонке древесины. Сейчас производится синтетическим методом из водяного газа. Служит растворителем и сырьем в химической промышленности. Этиловый, иначе винный, спирт, СН3СН2ОН (метилкарбинол, этанол), бесцветная жидкость с т. кип. 78,3°С, приятного запаха, опьяняющего свойства. В Чехословакии производится путем сбраживания сахаросодержащих растворов, в других случаях - синтетически из этилена крекинг-газов. Винный спирт идет, главным образом, на приготовление спиртных напитков, одеколона; применяется как растворитель и как сырье в органической химии. Бензиловый спирт, - C6H5CH2OH, и фенилэтиловый спирт, С6Н5СН2СН2ОН, жидкости приятного запаха, применяемые в парфюмерии. Гликоль, СН2ОН * СН2ОН (этандиол), густая жидкость, раствор которой замерзает лишь при температурах значительно ниже нуля (применяется в холодильниках). Глицерин, пропантриол, бесцветная вязкая жидкость с т. кип. 200°С, сладкая на вкус. Входит в состав жиров, из которых и получается. Сейчас производится и синтетически из пропилена крекинг-газов. Широко применяется в косметике (смягчает кожу) и в производстве нитроглицерина. Циклогексанол - бесцветная жидкость с т кип. 161,5°С. Получается гидрированием фенола в присутствии катализаторов.
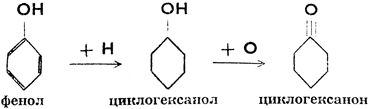
Циклогексанол служит сырьем для получения синтетических волокон (найлон, силон). При окислении превращается в циклогексанон (кетон).
е) Фенолы
Благодаря наличию ароматического ядра, группа -ОН в фенолах приобретает кислотный характер, т. е. фенолы ведут себя как кислоты. Со щелочами они образуют феноляты, которые в отличие от алкоголятов растворимы в воде (алкоголяты водой разлагаются), что используется при производстве фенолов из дегтя. При этом происходит реакция: С6Н5ОН + NaOH = [C6H5О]-Na+ + Н2О. Фенолы можно получать также путем сплавления солей сульфокислот с NaOH.
Фенол, С6Н5ОН, или карболовая кислота, кристаллическое вещество, с т. пл. 43°С и т. кип. 183°С. Используется для дезинфекции. Однако еще больше ее значение как сырья в производстве красителей, взрывчатых веществ и пластмасс (бакелит). Крезолы, С6Н4СН3ОН (о-, m- и р-), и нафтолы, С10Н7ОН, применяются подобно фенолу. Диоксибензолов, С6Н4(ОН)2, три: пирокатехин (о-), резорцин (m-) и гидрохинон (р-). Это кристаллические вещества. Пирогаллол, С6Н3(ОН), - трехатомный фенол, тоже кристаллический. Все они применяются в фотографии как проявители и служат для производства красителей и лекарств.
ж) Эфиры
Молекулу эфиров характеризует оксидная группа -С-О-С-. Эфиры получаются дегидратацией спиртов или из алкоголятов (фенолятов) при действии на них галогенидов согласно формулам:
2 СН3СН2ОН - Н2О = СН3СН2-О-СН2СН3 (этиловый эфир) (нагреванием с концентрированной H2SО4) и СН3СН2Вr + NaOC6H5 = NaBr + СН3СН2-О-С6Н5, фенилэтиловый эфир (фенетол).
Эфиры - вещества чрезвычайно устойчивые. При нормальных условиях они не вступают в реакцию ни с кислотами, ни со щелочами и не изменяются от действия окислителей. Поэтому их широко применяют в качестве растворителей органических веществ.
Диэтиловый эфир, СН3СН2-О-СН2СН3, эфир, бесцветная жидкость приятного запаха с т. кип. 34,6°С. Прекрасный растворитель органических веществ, в медицине применяется как наркотическое средство. Гофманские капли представляют смесь винного спирта с эфиром (1:3). Анизол, С6Н5-О-СН3, ифенетол, С6Н5-О-СН2СН3, приятно пахнущие жидкости, применяющиеся при производстве духов. Сложнее структура содержащегося в древесном дегте гваякола и являющегося составной частью гвоздичного масла эвгенола. Окись этилена, 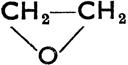 , это эфир гликоля. Производится из этилена. Служит сырьем в производстве ценных растворителей. Много сходства со спиртами, фенолами и эфирами у меркаптанов и тиоэфиров (сульфидов), в которых место кислорода занимает сера. Например, CH3SH, - метантиол, метилмеркаптан, C6H5SH, тиофенол, СН3-S-СН3, диметилсульфид и т. д. Все они отличаются весьма неприятным запахом.
, это эфир гликоля. Производится из этилена. Служит сырьем в производстве ценных растворителей. Много сходства со спиртами, фенолами и эфирами у меркаптанов и тиоэфиров (сульфидов), в которых место кислорода занимает сера. Например, CH3SH, - метантиол, метилмеркаптан, C6H5SH, тиофенол, СН3-S-СН3, диметилсульфид и т. д. Все они отличаются весьма неприятным запахом.
з) Альдегиды и кетоны
Альдегиды характеризуются альдегидной группой - 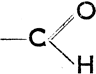 , а кетоны карбонильной группой > С = О (=СО). О том, как они образуются. Согласно женевской номенклатуре названия альдегидов кончаются на -аль, так что произведенные от основных углеводородов эти названия будут: для НСНО метаналь (формальдегид), для СН3СНО этаналь (ацетальдегид), для СН3СН2СНО пропаналь и т. д. Так как окисляясь ацетоны обращаются в карбоновые кислоты, то НСНО (формальдегид) называется также альдегидом муравьиной кислоты (НСО2Н), СН3СНО - альдегидом уксусной кислоты (СН3СО2Н) и т. д. В названиях кетонов окончание -он присоединяется к названию углеводорода и сопровождается цифрой, указывающей на положение карбонильной группы, напр. СН3СОСН3, - пропанон (ацетон), СН3СН2СОСН3, - бутанон-2, СН3СН2СОСН2СН3, - пентанон-3 и т. д.
, а кетоны карбонильной группой > С = О (=СО). О том, как они образуются. Согласно женевской номенклатуре названия альдегидов кончаются на -аль, так что произведенные от основных углеводородов эти названия будут: для НСНО метаналь (формальдегид), для СН3СНО этаналь (ацетальдегид), для СН3СН2СНО пропаналь и т. д. Так как окисляясь ацетоны обращаются в карбоновые кислоты, то НСНО (формальдегид) называется также альдегидом муравьиной кислоты (НСО2Н), СН3СНО - альдегидом уксусной кислоты (СН3СО2Н) и т. д. В названиях кетонов окончание -он присоединяется к названию углеводорода и сопровождается цифрой, указывающей на положение карбонильной группы, напр. СН3СОСН3, - пропанон (ацетон), СН3СН2СОСН3, - бутанон-2, СН3СН2СОСН2СН3, - пентанон-3 и т. д.
Что касается их химических свойств, то путем восстановления альдегиды обращаются в первичные спирты, путем окисления - в карбоновые кислоты. Кетоны восстанавливаются во вторичные спирты, не поддаются окислению и только при применении более сильных окислителей разлагаются на соединения с меньшим числом углеродных атомов. С NaHSО3 альдегиды дают следующую реакцию: 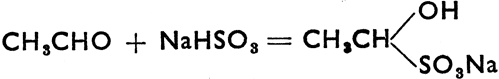 . Это соединение хорошо кристаллизуется, а поэтому вместе с NaHSO3 применяется для очистки и выделения некоторых альдегидов. Альдегиды, в молекуле которых есть группа -СНО, связанная атомом углерода, не связанным в свою очередь с атомом водорода, дают реакцию Канниццаро:
. Это соединение хорошо кристаллизуется, а поэтому вместе с NaHSO3 применяется для очистки и выделения некоторых альдегидов. Альдегиды, в молекуле которых есть группа -СНО, связанная атомом углерода, не связанным в свою очередь с атомом водорода, дают реакцию Канниццаро:
2 C6H5CHO + NaOH = С6Н5СН2ОН + С6Н5СООNa,
т. е. из альдегида получаются первичный спирт и карбоновая кислота.
Формальдегид, НСНО, метаналь, - бесцветный газ с едким запахом, сильное дезинфекционное средство. Его 40%-ный раствор в воде называется формалином. Служит сырьем для производства бакелита, фаолита и дезинфекционных средств. Ацетальдегид, СН3СНО, этаналь, бесцветная жидкость с т. кип. 20,8°С. Производится из ацетилена, является сырьем для производства уксусной кислоты, винного спирта и синтетического каучука. Бензойный альдегид, С6Н5СНО, - бесцветная жидкость с т. кип. 179°С. Обладает приятным запахом горького миндаля, содержится в ядрах горького миндаля и других плодов (настоящее горько-миндальное масло). Производится из толуола, применяется в парфюмерии, а также в качестве сырья для производства красителей и лекарств. Ацетон, СН3СОСН3, пропанон, - бесцветная жидкость с приятным запахом и т. кип. 56,5°С. Ценный растворитель органических веществ (ацетилена в баллонах), исходный материал в производстве лекарств.
Добытые из ароматических углеводородов двухатомные кетоны зовутся хинонами. Получаются они окислением двухатомных фенолов и имеют структуру:
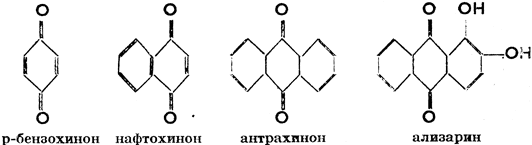
Из хинонов наибольшее значение имеет антрахинон. Кристаллизуется он в виде желтоватых иголочек с т. пл. 285 °С. Производится окислением антрацена (из дегтя); служит ценным сырьем для производства красок, в особенности ализарина (путем сульфирования антрахинона получается сульфокислота, соль которой сплавляется с NaOH).
и) Карбоновые кислоты и их производные
Карбоновые (органические) кислоты характеризуются функциональной группой 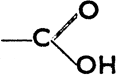 , которая называется карбоксильной группой (карбоксилом -СО2Н). Номенклатура кислот не отличается единством. Большинство низших кислот носит общепринятые названия (муравьиная, уксусная, масляная). Но названия их можно производить и от соответствующих углеводородов; в таком случае НСО2Н - это метановая кислота (муравьиная), СН3СН2СН2СО2Н - бутановая кислота (масляная) и т. д. Карбоновые кислоты получаются окислением углеводородов, первичных спиртов и альдегидов, напр.: С6Н5СН3 + 3 О = С6Н5СО2Н + Н2О; СН3СН2ОН + 2 О = CH3CO2H + Н2О; СН3СНО + О = СН3СО2Н.
, которая называется карбоксильной группой (карбоксилом -СО2Н). Номенклатура кислот не отличается единством. Большинство низших кислот носит общепринятые названия (муравьиная, уксусная, масляная). Но названия их можно производить и от соответствующих углеводородов; в таком случае НСО2Н - это метановая кислота (муравьиная), СН3СН2СН2СО2Н - бутановая кислота (масляная) и т. д. Карбоновые кислоты получаются окислением углеводородов, первичных спиртов и альдегидов, напр.: С6Н5СН3 + 3 О = С6Н5СО2Н + Н2О; СН3СН2ОН + 2 О = CH3CO2H + Н2О; СН3СНО + О = СН3СО2Н.
Карбоновые кислоты подобно кислотам минеральным можно нейтрализовать с образованием солей: СН3СО2Н + NaOH = [CH3CО2]-Na+ + Н2О. Вообще говоря карбоновые кислоты слабее обыкновенных минеральных.
Если отнять от формулы кислоты -ОН, то останутся группы с одной связью, так наз. ацилы. Это: НСО - формил, СН3СО - ацетил, СН3СН2СН2СО - бутурил, С6Н5СО - бензоил и т. д. Производные карбоновых кислот образуются при соединениях с карбоксилами. Хлорангидриды кислот образуются при действии РСl3 на кислоты, напр. 3 СН3СO2Н + РСl3 = Н3РO3 + 3 СН3СОСl - хлорангидрид уксусной кислоты (хлористый ацетил). Хлорангидриды кислот отличаются большой реактивностью. С водой они вновь образуют кислоты, а со спиртами - сложные эфиры по уравнениям: СН3СОСl + НОН = НСl + СН3СО2Н; - СН3СОСl + НОСН2СН3 = СН3СООСН2СН3 (уксусноэтиловый эфир) + HCl. Ангидриды образуются по схеме:
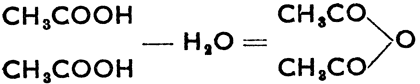 уксусный ангидрид (ацетангидрид).
уксусный ангидрид (ацетангидрид).
Получаются нагреванием хлорангидрида с уксуснокислым натрием. Амиды кислот образуются действием NH, на хлорангидриды кислот, напр.: СН3СОСl + HNH2 = HCl + CH3CONH2, амид уксусной кислоты (ацетамид). Могут быть получены также путем нагревания:
CH3CO2NH4 - Н2О = CH3CONH2.
Нитрилы кислот получаются действием дегидратационных реактивов на амиды, теряя воду по формуле:
CH3CONH2 - Н2О = CH2CN,
- нитрил уксусной кислоты (метилцианид). Простейшим нитрилом является нитрил муравьиной кислоты HCN,
- цианистый водород.
Сложные эфиры кислот получаются путем этерификации, напр.:
СН3СООН + НОСН2СН3 = Н2О + СН3СООСН2СН3,
уксуснокислый эфир, причем водород карбоксила заменяется алкилом или арилом. Так напр. НСООСН3 - метиловый эфир муравьиной кислоты, CH3COOC5H11 - амилацетат, С6Н5СООСН3 - метиловый эфир бензойной кислоты и т. д. Низшие сложные эфиры - это приятно пахнущие жидкости, применяемые в парфюмерии; высшие - твердые вещества. Действием кислот и оснований они гидролизуются, напр.:
СН3СООС5Н11 + НОН = СН3СO2H + С5Н11ОН, т. е. разлагаются на кислоту и спирт.
Наиболее важны в техническом отношении из сложных эфиров - глицериды, т. е. эфиры высших жирных кислот (С15Н31СO2Н - пальмитиновая, С17Н35СO2Н - стеариновая, С17Н33СO2Н - олеиновая кислота) с глицерином, представляющие собой основу животных и растительных жиров. При кипячении жиров с NaOH (щелочное омыление) жиры разлагаются (как и сложные эфиры) на глицерин и соли жирных кислот, так наз. мыла. Этот процесс протекает по уравнению:
С3Н5(ОСОС17Н35)3 + 3 NаОН (стеарат глицерина (жир)) = 3 С15Н35СО2Nа+ (стеарат Nа (мыло)) + С3Н5(ОН)3 (глицерин)
которое является основой производства глицерина и мыла из жиров.
Растительные масла, содержащие глицериды ненасыщенных высших кислот (линолевой и линоленовой), на воздухе подвергаются полимеризации, т. е. превращаются в смолистые вещества. Такие "высыхающие" на воздухе масла (напр. льняное) используются для приготовления олифы.
Замещенные кислоты образуются путем замены атомов водорода в молекулах кислот, причем карбоксил остается неизменным. Галоген-кислоты: СН2СlСO2Н, СНСl2СO2Н и ССl3СO2Н (моно-, ди- и трихлоруксусная кислоты). Являются продуктами хлорирования уксусной кислоты. Оксикислоты: СН2(OН)СO2Н, оксиуксусная (гликолевая); βСН3αСН(ОН)СО2Н, α-оксипропионовая (молочная); - βСН2(ОН)αСН2СО2 β-оксипропионовая; С6Н4(ОН)СО2Н, ортооксибензойная кислота (салициловая); С6Н2(ОН)3СО2Н, триоксибензойная (галловая) и т. д. Аминокислоты: CH2(NH2)CО2H, аминоуксусная (гликокол); βCH3αCH(NH2)СО2Н, α-аминопропионовая (аланин) и т. д. Аминокислоты биологически очень важны, т. к. входят в молекулы белков, представляющих основу животных тканей.
Многоосновные кислоты имеют в молекулах две или больше карбоксильные группы. В зависимости от этого различаются кислоты двуосновные, трехосновные и т. д., напр.:

Муравьиная кислота, НСО2Н, бесцветная жидкость, пахнущая муравьями. Содержится в волосках жгучей крапивы и в яде некоторых насекомых. Уксусная кислота, СН3СО2Н, бесцветная жидкость с резким запахом. Чистая (ледяная) при охлаждении кристаллизуется, разбавленная используется как уксус. Ее соли - ацетаты. Акриловая кислота, СН2 = СНСО2Н, резко пахнущая жидкость с т. кип. 140°С. Легко полимеризуется (так же, как и ее эфиры), образуя искусственные пластмассы (полиакрилаты), так наз. органическое стекло. Бензойная кислота, С6Н5СО2Н, бесцветные пластинки с т. пл. 121,7°С. Сама кислота и ее соли, называемые бензойными, обладают консервирующими свойствами. Кислоты фенилуксусная, C6H5CH2CО2H, и коричная, С6Н5СН = СНСО2Н (фенилакриловая) используются в производстве духов. Кислоты щавелевая, янтарная, яблочная, винная и лимонная - кристаллические твердые вещества. Находятся в вегетативных органах растений и в плодах и являются причиной их кислого вкуса. Техническое значение имеет адипиновая кислота, которая образуется при окислении циклогексана, и служит сырьем для производства некоторых современных пластмасс. Молочная кислота, СН3СН(ОН)СО2Н (α-оксипропионовая) образуется при молочнокислом брожении сахара, содержится в кислой капусте и огурцах. Производится путем молочнокислого брожения Сахаров. В очищенном виде применяется при изготовлении лимонадов, в неочищенном - в кожевенной промышленности. Салициловая кислота, С6Н4(ОН)СО2Н, кристаллизуется в виде иголочек, т. пл. 155°С. Консервирующее средство (ядовита), используется для производства салола (салицилово-фениловый эфир) и аспирина: 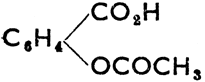 (ацетилсалициловая кислота), известного лекарства. Фталевая кислота, С6Н4(СО2Н)2, производится путем каталитического окисления нафталина кислородом воздуха. Так как реакция наступает только при 450°С, то она образуется при этом в форме ангидрида (фталевый ангидрид). Кристаллизуется в белых иглах; т. пл. 131°С. Является сырьем в производстве красителей (фталеинов) и пластмасс (глипталей).
(ацетилсалициловая кислота), известного лекарства. Фталевая кислота, С6Н4(СО2Н)2, производится путем каталитического окисления нафталина кислородом воздуха. Так как реакция наступает только при 450°С, то она образуется при этом в форме ангидрида (фталевый ангидрид). Кристаллизуется в белых иглах; т. пл. 131°С. Является сырьем в производстве красителей (фталеинов) и пластмасс (глипталей).
к) Углеводы
Этим названием обозначаются широко распространенные в природе вещества, возникающие в растительных организмах путем ассимиляции, сложной химической реакции, в которой участвуют вода, СО2 из воздуха и которой содействуют зерна хлорофилла, находящиеся в зеленой листве растений, и солнечный свет. Различаются углеводы:
а) простые, с определенным молекулярным весом (моносахариды: глюкоза, фруктоза и галактоза, дисахариды: сахароза, мальтоза и лактоза).
б) сложные, полисахариды, молекулярный вес которых неизвестен (крахмал, декстрин, целлюлоза),
Моносахариды производятся из шестиатомных спиртов, гекситов, которые могут быть окислены по схеме:
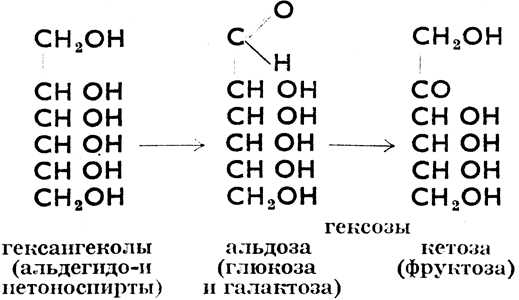
У всех одна и та же молекулярная формула C6H12O6.
Сложные сахара характеризуются тем, что при гидролизе (кислотами) они, разлагаясь, дают моносахариды. Напр.:
С12Н22О11 + Н2О (полисахарид (кислота)) = С6Н12О6 + С6Н12О6Ο (моносахриды)
Полисахариды гидролизом разлагаются по схеме:
(С6Н10О5)n + n Н2О (полисахарид (кислота)) = n С6Н12О6 (моносахариды)
Глюкоза - важнейшая альдогексоза. Иначе называется виноградным сахаром, крахмальным сахаром (получается в больших количествах из крахмала) и декстрозой. Вместе с фруктозой содержится в меде, сладких фруктах и в крови (у страдающих сахарной болезнью выделяется с мочей). Легко подвергается брожению. Применяется для подслащения ликеров, в производстве конфет и т. д. Галактоза подобна глюкозе, получается гидролизом лактозы (молочного сахара). Фруктоза - это кетоногектоза, называется также фруктовым сахаром и левулезой. Содержится в сладких фруктах и вместе с глюкозой входит как главная составная часть в мед. Является составной частью сахарозы. Сахароза (свекловичный или тростниковый сахар) - дисахарид, в Чехословакии производится из сахарной свеклы (7% мирового производства). То же - в Советском Союзе, и в еще гораздо больших размерах. Действием кислот разлагается на глюкозу и фруктозу (так наз. инвертированный сахар или искусственный мед). В промышленности служит для подслащения ликеров и приготовления конфет. Мальтоза (солодовый сахар) - дисахарид, содержащийся в сусле (водном растворе экстрактивных веществ солода, продукта искусственного проращивания злаковых зерен). При прорастании злаков образуется особое вещество (энзим) диастаз, обладающее способностью переводить крахмал в солодовый сахар. Благодаря этому крахмал ячменя служит исходным продуктом в пивоварении (12%-ное пиво не содержит 12% спирта, но в подвергшемся сбраживанию сусле было 12% мальтозы). На спиртовых заводах крахмалистая жидкая масса (образовавшаяся путем разваривания картофеля) при добавлении солода о сахаривается, т. е. из крахмала выделяется солодовой сахар, который подвергают брожению, и из перебродившей жидкости перегонкой получают спирт. Лактоза (молочный сахар) - дисахарид, содержится в молоке всех млекопитающих. Добавляется к укрепляющим здоровье лекарствам (легко усваивается) и к лекарствам порошкообразным (не отсыревает). Крахмал (С6Н10О5)n - запасное вещество растений. Образуется в листьях и скопляется в зернах (злаки) и в клубнях (картофель), откуда и добывается. При нагревании или при умеренном воздействии кислот обращается в декстрин (клей). При более сильном действии кислот окончательно разлагается с образованием глюкозы (крахмальный сахар). Целлюлоза (С6Н10О5)n - главная составная часть клеточной стенки растений. Выделяется как клетчатка из древесины. Наиболее чистая целлюлоза - вата (очищенные волокна хлопка). Древесная клетчатка идет на производство бумаги или нитруется. Полученная таким образом нитрованная целлюлоза служит исходным материалом в производстве целлулоидови нитроцеллюлозы (пироксилина). Кроме того клетчатка действием NaOH с CS2 перерабатывается в вискозу, являющуюся главным видом сырья в производстве целлофана и искусственного вискозного шелка.
л) Производные угольной кислоты
Угольная кислота, Н2СO3, несмотря на то, что она в свободном состоянии неизвестна (при ее выделении в чистом виде тотчас разлагается на Н2О и СO2), дает немалое число органических соединений. Так, напр., замещая в ее молекуле группы -ОН, получаем:
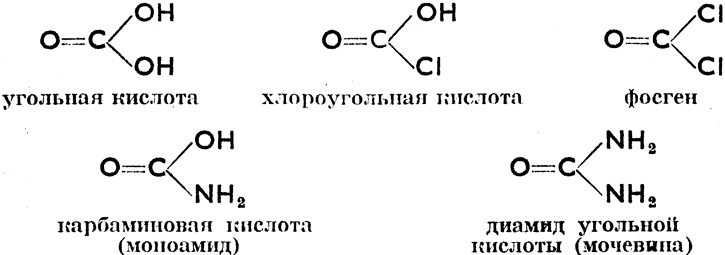
Мочевина (карбамид), CO(NH2)2, образуется в организме млекопитающих путем разложения белков и всегда присутствует в моче. В больших количествах производится из аммиака и углекислого газа. Образует бесцветные кристаллы с т. пл. 133°С. Растворима в воде. Применяется как удобрение и как сырье в производстве пластмасс, так наз. аминопластов. Тиомочевина, CS(NH2)2, тиокарбамид, сернистый аналог мочевины - кристаллическое вещество с т. пл. 180 °С. Применяется в производстве пластмасс. Уреиды - соединения, получающиеся присоединением к мочевине двухатомных карбоновых кислот. Так напр.:
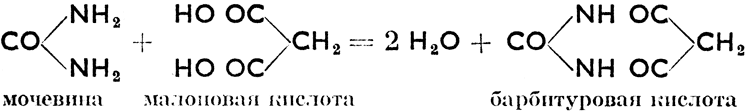
Производными барбитуровой кислоты являются известные снотворные средства - веронал (диэтилбарбитуровая к.) и люминал (фенилэтилбарбитуровая к.). Диуреиды образуются из двух молекул мочевины. Среди диуреидов соединения большого физиологического значения, каковы теобромин (в бобах какао), кофеин и теин (в кофе и чае), а также мочевая кислота, находящаяся в незначительном количестве в моче. При известных патологических состояниях мочевая кислота, образуясь в большом количестве, откладывается вследствие своей слабой растворимости в организме человека, являясь таким образом причиной серьезных заболеваний.
м) Гетероциклические соединения
Гетероциклические соединения - это такие циклические соединения, в кольце которых кроме атомов углерода есть также один или несколько атомов других элементов (гетероатомы). Структура наиболее известных гетероциклических соединений была уже приведена ранее. В большинстве случаев это жидкости: фуран, с т. кип. 32°С, тиофен с т. кип. 84°С, пиррол с т. кип. 131°С, пиридин с т. кип. 115°С, хинолин с т. кип. 238°С и изохинолин с т. кип. 240°С. Техническое значение имеют: пиридин, как ценный растворитель, фуран, дающий при каталитической гидрогенизации тетрагидрофуран, жидкость с т. кип. 65°С. Тетрагидрофуран служит исходным материалом в производстве адипиновой кислоты и гексаметилендиамина, H2N(CH2)6NH2, являющихся основным сырьем в производстве высокомолекулярных полиамидов (найлона, перлона и силона). К гетероциклическим соединениям принадлежат также алкалоиды, основания растительного происхождения, содержащиеся в некоторых органах растений. Важнейшие алкалоиды: кокаин, никотин, атропин, скополамин, бруцин, хинин, стрихнин, эметин, папаверин, кодеин, морфин, теобромин, кофеин и т. д. Сейчас в большинстве случаев они получаются синтетически. Почти все алкалоиды являются сильными ядами. Принятые внутрь в незначительном количестве действуют как эффективные лекарства.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'