
Динамические модели ковалентной связи
Характерная черта динамических моделей химической связи состоит в том, что их авторы старались найти такие траектории движения электронов в молекулах (причем рассматривались, как правило, простейшие системы: Н+2, Н2), при которых между ядрами существовал бы некоторый эффективный отрицательный заряд. При этом модели молекул строились исходя из принятой модели атома, изоэлектронного данной молекуле. Например, орбиты электронов в молекуле Н2 определялись авторами путем мысленного расщепления ядра гелия на два ядра водорода и адиабатического разведения последних на расстояние, соответствующее длине химической связи в молекуле водорода.
При определении энергетической последовательности молекулярных термов Хунд и Малликен использовали аналогичный прием (правда, они рассматривали два крайних случая: "объединенного" и "разделенных" атомов). Получаемые в доквантовомеханических теориях электронные траектории отличались (иногда существенно!) друг от друга. Так, Н. Бор предложил в 1913 г. модель молекулы водорода, согласно которой ядра находятся в полюсах эллипсоида, а два электрона вращаются по его малому экватору (т. е. плоскость вращения перпендикулярна линии, проходящей через ядра). При вращении электроны находятся всегда в диаметрально противоположных положениях. Кинетическая энергия Екин = hω/2 (где ω - частота вращения) квантуется, так как квантуется момент импульса системы, а следовательно, и частота ω.
Другая динамическая модель молекулы Н2 была предложена Ленгмюром в 1920 г., согласно которой электроны совершают колебательные движения по незамкнутым траекториям (рис. 2, а).
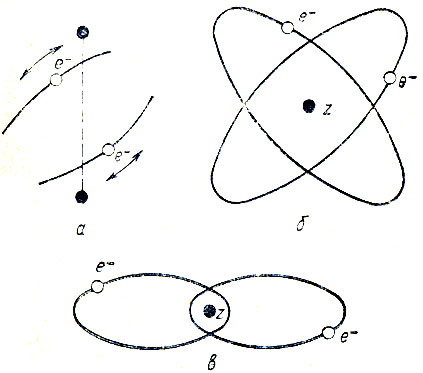
Рис. 2. Динамические модели молекулы водорода; а - по Ленгмюру; б - по Бору-Кэмблу-Паули (модель 'перекрещивающихся орбит'); в - по Зоммерфельду-Гейзенбергу
Довольно распространенной в начале 20-х годов была модель "перекрещенных" орбит (crossed-orbit model), рассмотренная в работах Кэмбла, Бора, Паули, Борна, Ниссена, Ван Флека и Крамерса. Траектории электронов в атоме Не и в молекуле Н2, постулированные в такой модели, показаны на рис. 2, б. Расчеты Ван Флека и Крамерса показали, что орбиты должны перекрещиваться под углом 57,7°-58,2°, кроме того, существует прецессия орбит вокруг оси z. В ионе Н+2 электрон может двигаться по обеим орбитам попеременно. Квантовые условия Бора-Зоммерфельда требуют при этом, бы результирующий момент импульса системы равнялся h/2π и ее средняя кинетическая энергия была h(ωn+1/2 ωk), где ωn - круговая частота обращения электрона по n-й орбите, а ωк - частота прецессии k-й орбиты вокруг оси z.
Кроме указанных, были предложены и другие модели, напимер, Зоммерфельда и Гейзенберга ("модель проникающих эллипсов") (рис. 2, в). Однако детальный расчет движения электронов в этом случае показал, что должна иметь место прецессия орбит, в результате которой, согласно замечанию Паули, электроны должны падать на ядро Не (или водорода, если речь идет о молекуле Н2).
Все приведенные выше динамические модели имели один существенный недостаток - при детальном анализе оказывалось, что они не могут объяснить устойчивости молекулы, хотя были использованы правила квантования Бора-Зоммерфельда или их модификации. Это наводило на мысль, что существующая квантовая теория не может объяснить электронное строение молекул. По образной характеристике Джаммера, "старая квантовая теория представляла собой жалкую смесь гипотез, принципов, теорем и вычислительных рецептов, а не логически последовательную теорию. Каждая квантовотеоретическая проблема сначала решалась в терминах классической физики, а затем это классическое решение проходило сквозь таинственное решето квантовых условий или, как это происходило в большинстве случаев, классическое решение переводилось согласно принципу соответствия на квантовый язык. Обычно процесс осуществления "корректного перевода" был предметом искусного гадания и интуиции, а не дедуктивного и систематического вывода. Фактически квантовая теория была областью особого мастерства и даже артистической техники, которая была развита до наивысшей возможной степени совершенства в Геттингене и в Копенгагене. Короче говоря, квантовая теория не обладала двумя существенными особенностями зрелой научной теории: концептуальной автономией и логической согласованностью" [56, с. 196].
Только с возникновением квантовой механики создались предпосылки для реального решения проблем химической связи и валентности. Но чтобы лучше представить себе тот сложный исторический путь, который вел от классической теории химического строения через электронные концепции к созданию квантовохимических методов, мы остановимся на попытках некоторых ученых построить формально-математическую модель, способную передать основные положения классической структурной химии.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'