
Глава 3. Развитие основных концепций квантовомеханнческой теории химической связи
Объяснение природы химической связи в молекуле водорода. Метод Гайтлера-Лондона
Современная квантовая химия берет начало с работы немецких ученых Вальтера Гайтлера и Фрица Лондона "Взаимодействие нейтральных атомов и гомеополярная связь с точки зрения квантовой механики", опубликованной в 1927 г. [50].
Используя математический аппарат квантовой механики, Гайтлер и Лондон решили задачу об изменении энергии двух электронейтральных атомов водорода, находящихся в основном состоянии, когда их ядра сближаются до конечного расстояния R. Задача решалась в терминах квантовомеханической теории возмущений, использованной незадолго до этого Вернером Гейзенбергом при анализе состояний двухэлектронной системы атома Не. Исследование Гейзенберга в известной мере подготовило почву для создания теории гомеополярной (ковалентной) химической связи, однако, как будет показано дальше, между его подходом и методом Гайтлера-Лондона имеются некоторые различия.
Гайтлер и Лондон аппроксимировали двухэлектронную функцию, описывающую электронное состояние молекулы Н2, произведением одноэлектронных функций (орбиталей) а(r) и b(r) изолированных атомов водорода, центрированных на конечном расстоянии друг от друга. Разумеется, обе функции имеют при этом одинаковый вид:
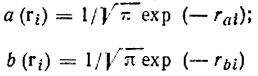 (3.1)
(3.1)и отвечают локализации i-го электрона соответственно около ядра A и В.
Однако, как замечают авторы, их выводы остаются в силе, если а(r) и b(r) "различны и по своей структуре, так что приведенное рассмотрение распространяется на значительно более общий случай" [50, с. 457], т. е. на другие молекулы.
В качестве невозмущенных собственных функций Гайтлер и Лондон выбрали такие, которые соответствуют локализации одного электрона у ядра А, а другого - у ядра В. Если несвязанные атомы А и В рассматривать как единую систему, то произведение соответствующих им собственных функций представляет собой собственную функцию этой системы, причем можно построить две двухэлектронные функции вида: а(r1)*b(r2) (первый электрон около ядра A, второй - около ядра В); a(r2)b(r1) (первый электрон около ядра В, второй - около ядра А).
Обе возможности соответствуют одной и той же энергии системы (удвоенной энергии атома водорода) - случай двукратного вырождения. Любые две линейные комбинации
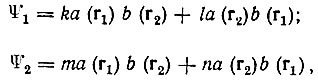 (3.2)
(3.2)удовлетворяющие условиям нормировки и ортогональности:
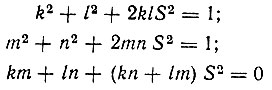 (3.3)
(3.3)
[где 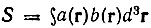 - интеграл перекрывания атомных орбиталей а(r) и b(r)] следует рассматривать как невозмущенные собственные функции двухэлектронной задачи. Коэффициенты k, l, m, n можно определить из одних только условий симметрии. При этом оптимальные функции нулевого приближения теории возмущений для рассматриваемого существенно вырожденного случая будут иметь вид:
- интеграл перекрывания атомных орбиталей а(r) и b(r)] следует рассматривать как невозмущенные собственные функции двухэлектронной задачи. Коэффициенты k, l, m, n можно определить из одних только условий симметрии. При этом оптимальные функции нулевого приближения теории возмущений для рассматриваемого существенно вырожденного случая будут иметь вид:
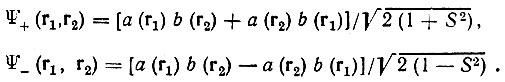 (3.4)
(3.4)
Очевидно, что функции 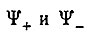 нормированны и ортогональны.
нормированны и ортогональны.
Применив стандартную теорию возмущений, Гайтлер и Лондон нашли, что поправки к энергии нулевого приближения, соответствующие функциям 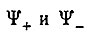 , определяются формулами:
, определяются формулами:
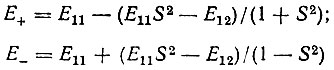 (3.5)
(3.5)или в объединенной форме:
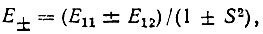 (3.6)
(3.6)где
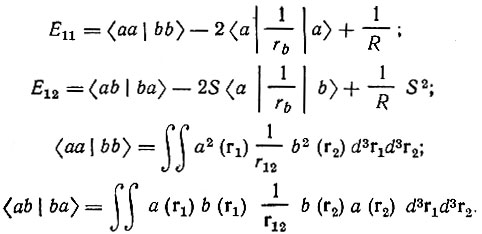
Наиболее интересным с химической точки зрения является второй параграф работы Гайтлера и Лондона, посвященный анализу формул. Прежде всего авторы указывают на трудность физической интерпретации полученного в предыдущем параграфе результата, согласно которому "два нейтральных атома могут взаимодействовать двумя различными способами... От истинного понимания этого обстоятельства мы еще, вероятно, далеки. Но желательно выяснить, по крайней мере с математической точки зрения, причину появления этой замечательной двойственности (zweideutigkeit)" [50, с. 458].
С этой целью Гайтлер и Лондон используют следующие рассуждения. При бесконечном удалении ядер 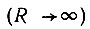 энергия системы двукратно вырождена соответственно двум возможным распределениям неразличимых электронов по электронейтральным атомам водорода. "В то время как в классической механике существует возможность четко различать электроны, "наклеить этикетку" (электрон для этого необходимо поместить в достаточно глубокую потенциальную яму и изолировать от всякого доступа энергии), что-либо подобное в квантовой механике невозможно. Если в некоторый момент времени известно, что один электрон находится в потенциальной яме, никогда нельзя быть уверенным, что уже в следующий момент он не обменяется с другим электроном" [50, с. 460].
энергия системы двукратно вырождена соответственно двум возможным распределениям неразличимых электронов по электронейтральным атомам водорода. "В то время как в классической механике существует возможность четко различать электроны, "наклеить этикетку" (электрон для этого необходимо поместить в достаточно глубокую потенциальную яму и изолировать от всякого доступа энергии), что-либо подобное в квантовой механике невозможно. Если в некоторый момент времени известно, что один электрон находится в потенциальной яме, никогда нельзя быть уверенным, что уже в следующий момент он не обменяется с другим электроном" [50, с. 460].
При сближении атомов упомянутое выше двукратное вырождение снимается и сходный энергетический уровень Е0 расщепляется на два 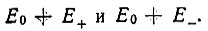 Чтобы выяснить относительное расположение этих уровней, авторы обратились к теории Штурма-Лиувилля, согласно которой безузловой собственной функции соответствует наименьшее собственное значение.
Чтобы выяснить относительное расположение этих уровней, авторы обратились к теории Штурма-Лиувилля, согласно которой безузловой собственной функции соответствует наименьшее собственное значение.
Таким образом, уже из ацализа узловой структуры функции 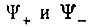 следует, что
следует, что 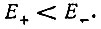
Снятие вырождения связано при этом, как указывают Гитлер и Лондон, "с неисчезновением собственной функции атома А в окрестности атома В и наоборот... Это обстоятельство свидетельствует о том, что должна существовать конечная вероятность для электрона атома А принадлежать атому В. Величину 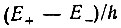 следует трактовать как частоту, с которой в среднем происходит обмен электронами" [50, с. 461].
следует трактовать как частоту, с которой в среднем происходит обмен электронами" [50, с. 461].
При этом авторы подчеркивают различие между понятием резонанса у Гейзенберга и понятием обмена. В то время как резонанс, согласно Гейзенбергу, означает, что электроны находящиеся в различных состояниях (описываемых собственными функциями одной и той же системы ортогональных функций), обмениваются своей энергией, в случае, рассмотренном Гайтлером и Лондоном, электроны "меняются своими местами", причем состояния этих электронов характеризуются одной и той же энергией и описываются неортогональными функциями, принадлежащими к различным системам. Далее мы подробно обсудим понятия обмена и частоты обмена.
Выполненные Гайтлером и Лондоном вычисления показали, что в окрестности равновесного межъядерного расстояния R0 величина Е+, представляющая изменение энергии при сближении атомов как функцию от R, отрицательна и имеет минимум, тогда как кривая, показывающая зависимость Е- от R, такого минимума не имеет (рис. 11).
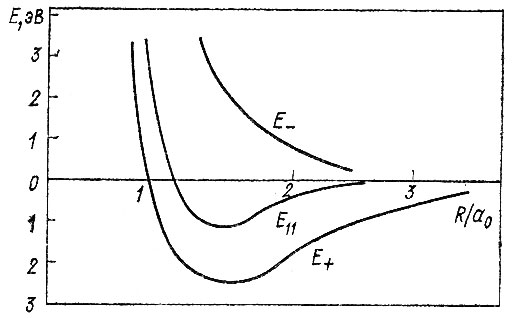
Рис. 11. Зависимость энергии молекулы водорода от межъядерного расстояния
Кулоновский интеграл (Е11) и интеграл перекрывания (S) Гайтлер и Лондон выразили в аналитическом виде. Для интеграла 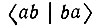 они ограничились оценкой. Впоследствии японский физик Сугиура вычислил этот интеграл и нашел следующие значения для Eмин и R0: Eмин=3,2 эВ (экспериментальное значение 4,75 эВ), R0 = 0,80 оА) (экспериментальное значение 0,741 оА). Но и для расчета Сугиуры из ряда приближенных вычислений Гайтлера и Лондона было ясно, что по порядку величины Емин и R0 совпадают с экспериментальными, чего не давала ни одна доквантовомеханическая теория ковалентной связи.
они ограничились оценкой. Впоследствии японский физик Сугиура вычислил этот интеграл и нашел следующие значения для Eмин и R0: Eмин=3,2 эВ (экспериментальное значение 4,75 эВ), R0 = 0,80 оА) (экспериментальное значение 0,741 оА). Но и для расчета Сугиуры из ряда приближенных вычислений Гайтлера и Лондона было ясно, что по порядку величины Емин и R0 совпадают с экспериментальными, чего не давала ни одна доквантовомеханическая теория ковалентной связи.
Было показано также, что большая часть энергии связи, характеризуемая Eмин, обусловлена обменным интегралом E12, принимающим в окрестности равновесного межъядерного расстояния большие по абсолютной величине отрицательные значения.
Следует отметить, что при обсуждении молекулы Н2 Гайтлер и Лондон не учитывали существования у электронов спина, что было сделано ими в следующих частях работы при обсуждении взаимодействия между атомами гелия (система четырех электронов).
При этом авторы ссылались на принцип Паули, "который оказался столь плодотворным при обсуждении электронной конфигурации отдельного атома и который они использовали в расширенном смысле, для системы двух взаимодействующих атомов, чтобы получить более узкий выбор квантовомеханически разрешенных способов их взаимодействия" [50, с. 466]. Гайтлер и Лондон формулируют принцип Паули следующим образом: "выбранные собственные функции системы при обмене двух электронов меняют (сохраняют) свой знак, если электроны имеют одинаковые (разные) спины (так называемая спиновая функция при этом не учитывается)" [50, с. 467].
Отметим, что в 1927 г. принцип Паули еще не был сформулирован в общем виде, на что и указано в работе Гайтлера и Лондона [50, примечание к с. 468]. Используя принцип Паули в приведенной формулировке и рассуждения, аналогичные предыдущим, авторы пришли к выводу о том, что "два атома Не (а также и все другие благородные газы) не могут отличаться друг от друга с точки зрения их спинов - в противоположность двум атомам водорода (и любым другим атомам с незамкнутыми оболочками) - и поэтому два атома могут существовать только по отдельности" [50, с. 467].
Общий вывод, к которому приходят Гайтлер и Лондон, таков: "... силы притяжения, приводящие к образованию гомеополярной связи в молекуле, исчезают как только химическая валентность насыщена... Между двумя системами, у которых спины электронов могут быть ориентированы только одним единственным образом (как это мы видели в случае Не), может существовать одно-единственное собственное колебание (Eigenschwingung)..., которое имеет один узел, и поэтому для таких систем, как и для Не, можно ожидать отталкивание. Этот случай, очевидно, имеет место уже тогда, когда, по крайней мере, одна из систем имеет замкнутую оболочку, так, например, для Н2 + Н2, Не + Н, Н + Н2 и т. п. Невозможность образования молекул Н3, Н4, НеН из невозбужденных атомов обусловливаетcя, впрочем, уже отсутствием вакансий в K -оболочке" [50, с. 468]. Этот вывод впоследствии распространен Лондоном и Гайтлером на более общий случай многоатомных молекул и составил идейную основу теории спин-валентности.
В конце своей работы авторы отмечают, что в рамках предложенного ими метода в принципе возможен учет ионных членов a(r1)a(r2) и b(r1)b(r2), соответствующих локализации обоих электронов у одного из ядер. Из соображений симметрии ясно, что эти два члена должны входить в двухэлектронную функцию с одинаковым весом. Однако, по мнению авторов, вклад этих функций достаточно мал, чтобы их можно было в первом приближении не учитывать.
Метод Гайтлера-Лондона в применении к молекуле водорода был впоследствии усовершенствован в работах Уанга, Розена, Вейнбаума и др.
Эти усовершенствования:
1) учитывали сжатие электронных облаков атомов водорода при образовании ими молекулы Н2; минимизировав энергию относительно значения эффективного заряда Z* (для изолированного атома Н Z* = Z = 1) при равновесном межъядерном расстоянии R0, получили оптимальное значение Z* = 1,166;
2) учитывали поляризацию атомных орбиталей в молекуле Н2 путем замены сферически-симметричной ls-функции на функцию вида
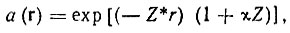
где помимо эффективного заряда Z* введен параметр поляризации χ; значения этих параметров определяли из вариационного принципа, т. е. минимизацией полной энергии системы;
3) включали в разложение двухэлектронной функции молекулы ионные структуры Н-Н+ и Н+Н-.
Наконец, в 1933 г. Джеймсом и Кулиджем была предпринята попытка учета электронной корреляции посредством введения в двухэлектронную волновую функцию молекулы Н2 межэлектронного расстояния r12.
Вычисления с функциями Джеймса и Кулиджа приводят к очень точным результатам (табл. 2), сравнимым по точности с экспериментом, но связаны с большими вычислительными трудностями.

Таблица 2. Результаты различных расчетов молекулы водорода
Вернемся, однако, к рассмотрению статьи Гайтлера и Лондона, а именно, обратимся к анализу понятий "обмена" и "частоты обмена", которые сыграли такую важную роль при объяснении природы химической связи. Следует отметить, что термин "обмен" употребляется Гайтлером и Лондоном в двух смыслах:
во-первых, как отражение того, что при образовании молекулы водорода из двух атомов имеется конечная вероятность обнаружения около атома НА электрона, принадлежащего первоначально атому НВ;
во-вторых, под обменом понимался периодический по времени процесс, происходящий с некоторой частотой обмена, равной разности энергетических уровней Е+ и Е- (соответствующих синглет-триплетному расщеплению исходного атомного терма) в единицах кванта действия h:
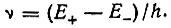 (3.7)
(3.7)Иными словами, Гайтлер и Лондон считали возможным дать сформулированной ими существенно квантовомеханической теории химической связи в молекуле Н2 псевдоклассическую интерпретацию в терминах происходящего с определенной частотой ν синхронного перескока электронов от атома к атому. Такая трактовка обменного интеграла получила довольно широкое распространение среди физиков и химиков, особенно в первое десятилетие существования квантовой химии. Тяготение к классическому осмыслению результатов квантовой механики в первые годы после ее создания было вполне естественным явлением. Однако допустимость и целесообразность классической интерпретации квантовомеханических понятий вызывает сомнения. Так, говоря об обмене, необходимо прежде всего подчеркнуть, что классическое понимание этого термина противоречит принципу неразличимости электронов, в силу которого нельзя сказать, какой из них в данный момент времени принадлежит одному атому, а какой - другому. Такое псевдоклассическое понимание обмена противоречит также постановке задачи, так как с самого начала речь шла о стационарных состояниях и рассматривалось стационарное уравнение Шредингера.
В действительности понятие обмена отражает перераспределение электронной плотности, получаемое в нулевом приближении теории возмущений, вследствие учета перестановочной симметрии. Говоря об обменном интеграле и связанных с ним эффектах, следует отметить ту существенную роль, которую в них играет перекрывание орбиталей а(r) и b(r), т. е. интеграл S. Действительно, при нулевом значении этого интеграла, фтогональные орбитали) обменный интеграл сводится к двух-электронному  , который является положительным, и, следовательно, энергетический уровень триплетного состояния в этом случае лежит ниже синглетного (ср. с правилом Хунда для атомов). Лишь существенное перекрывание атомных орбиталей обеспечивает большое и отрицательное значение обменного интеграла и связывающий характер основного (синглетного) состояния молекулы Н2 в методе Гайтлера-Лондона. Именно это легло в основу принципа максимального перекрывания Полинга-Малликена, согласно которому предполагается, что интегралы перекрывания могут рассматриваться как критерий прочности химической связи, а локализованные химические связи можно описывать сильно перекрывающимися парами орбиталей непосредственно связанных атомов.
, который является положительным, и, следовательно, энергетический уровень триплетного состояния в этом случае лежит ниже синглетного (ср. с правилом Хунда для атомов). Лишь существенное перекрывание атомных орбиталей обеспечивает большое и отрицательное значение обменного интеграла и связывающий характер основного (синглетного) состояния молекулы Н2 в методе Гайтлера-Лондона. Именно это легло в основу принципа максимального перекрывания Полинга-Малликена, согласно которому предполагается, что интегралы перекрывания могут рассматриваться как критерий прочности химической связи, а локализованные химические связи можно описывать сильно перекрывающимися парами орбиталей непосредственно связанных атомов.
Завершая обсуждение понятия обмена, подчеркнем, что появление интеграла Е12 определяется не только специфическим законом квантовой механики систем тождественных частиц, но и выбором математического аппарата, а именно, квантовомеханической теорией возмущений для вырожденного случая и построения двухэлектронных функций нулевого приближения из атомных орбиталей. Вообще говоря, одна и та же функция, описывающая состояние многоэлектронной системы, может быть представлена различным образом. Соответственно этому существует и неоднозначность в разложении энергии на составные части и неоднозначность выбора понятий, в терминах которых описывают многоэлектронную систему. Важно лишь "подтвердить, что не было пропущено ничего действительно существенного" (Э. Вигнер).
Из факта, что понятие обмена связано с определенными аппроксимациями (и в ряде методов, например в методе Джеймса и Кулиджа, не используется), не следует делать вывод, будто оно не отражает физической или химической реальности. Всякое конкретное понятие ограничено определенной моделью и преходяще, как и последняя. Но на определенном уровне приближения в нем выражены определенные черты, аспекты объективной реальности. Какие же стороны реальности отражает понятие обмена? Отчасти мы уже ответили на этот вопрос, когда говорили о существенной роли перекрывания атомных орбиталей. Действительно, то обстоятельство, что при образовании молекулы электроны, принадлежавшие ранее одним атомам, могут находиться в околоядерном пространстве других, является существенной чертой образования химической связи.
Кроме того, важной особенностью описания системы тождественных частиц является учет свойств перестановочной симметрии ее волновой функции без введения каких-либо новых динамических взаимодействий. Представляя (приближенно!) волновую функцию молекулы через произведения волновых функций отдельных электронов и учитывая свойства симметрии волновой функции, мы приходим к понятию квантового обмена, отражающему свойства системы тождественных микрочастиц (электронов), описываемой в рамках одноэлектронного приближения.
Хотя в первой работе Гайтлера и Лондона необходимость учета перестановочной симметрии была осознана еще не в полной мере, в их последующих работах (1928-1932 гг.) свойства симметрии волновых функций явились основой для создания общей теории многоэлектронных систем.
Наряду с молекулой Н2 Гайтлером и Лондоном была рассмотрена задача о взаимодействии двух атомов Не, каждый из которых находится в основном состоянии. Ввиду того что перестановочная симметрия многоэлектронных функций не была учтена должным образом, рассуждения авторов не могут считаться вполне корректными, хотя они и привели к правильному результату: атомы Не, обладающие замкнутыми электронными оболочками, не проявляют способности к химическому взаимодействию.
Впоследствии в литературе высказывались сомнения относительно применимости теории возмущений в задаче о молекуле водорода и обращалось внимание на необходимость более детального исследования волновых функций электронов в области потенциального барьера [10]. В указанных работах были получены точные асимптотические формулы для синглет-триплетного расщепления термов в молекуле на больших межатомных расстояниях. В то же время следует подчеркнуть, что метод Гайтлера-Лондона приводит к правильным значениям энергии и правильным волновым функциям системы при бесконечном разделении ядер, чего нельзя, к сожалению, сказать о методе МО - наиболее распространенном методе современной квантовой химии.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'