
Развитие метода МО в работе Леннард-Джонса
Почти сразу после своего возникновения метод Хунда-Малликена подвергся критике со стороны многих исследователей. Так, Герцберг [53] отметил трудности, с которыми сталкивались попытки интерпретировать некоторые экспериментальные факты, например, распад молекулярного иона N2+ (основное состояние) на атом N (основное состояние) и ион N+ (возбужденное состояние) на основе указанного метода.
Более того, он указал путь, позволяющий усовершенствовать эту теорию. Основываясь на идее Гайтлера и Лондона, согласно которой атомные орбитали в молекуле отчасти сохраняют свою индивидуальность, Герцберг предложил в качестве рабочей гипотезы сохранять за отдельными электронами в молекуле те квантовые числа, которыми они характеризовались в разъединенных атомах. Идеи Герцберга нашли поддержку в работе Леннард-Джонеа [58]. Последний считал недопустимым сопоставлять электронам в молекуле квантовые числа состояний, которые не могут быть реализованы. Значительно важнее, по его мнению, знать, что происходит с молекулой при ее диссоциации, чем рассматривать мысленный, физически нереализуемый процесс сжатия молекулярного полиэдра до слияния ядер*. Далее он обращает внимание на то, что систематика одноэлектронных состояний по Хунду и Малликену становится слишком сложной для молекул, включающих тяжелые атомы. Даже для атомов, высшие одноэлектронные состояния которых характеризуются главным квантовым числом 2, электронные оболочки пришлось бы обозначать символами 3dπ, 4pσ..., которые нелегко интерпретировать. Наконец, наиболее убедительным аргументом против использования квантовых чисел объединенного атома для описания многоатомной системы, приведенным Леннард-Джонсом, является абсурдность такого подхода в случае кристаллов. Так, куску свинца должен соответствовать объединенный атом с астрономическим зарядом ядра и всего лишь двумя 1s-электронами, двумя 2s-электронами и т. п., хотя ясно, что при образовании кристалла состояния 1s, а также состояния других электронов внутренних оболочек должны оставаться почти неизменными.
* (К сожалению, эта правильная методологическая установка Леннард-Джонеа не смогла быть применена до конца в методе МО, который оказался не в состоянии даже качественно описать процесс диссоциации молекул.)
Предлагая характеризовать электроны в молекуле квантовыми числами разъединенных атомов, Леннард-Джонс полагал, что принцип Паули можно считать выполняющимся, если, например, два 1s-электрона принадлежат к одному ядру или два - к другому. Более того, он считает возможным в некоторых случаях относить завершенные (замкнутые) оболочки к отдельным атомам. Таким образом, Леннард-Джонс различает атомные и молекулярные уровни даже в молекулах, причем только последние он считает ответственными за образование химической связи, что было, вообще говоря, нетривиальным моментом, так как детального теоретического анализа электронной структуры молекул в то время еще не было сделано.
Далее Леннард-Джонс ввел широко используемые в настоящее время при качественном рассмотрении химической связи диаграммы, связывающие одноэлектронные уровни молекулы с соответствующими уровнями разъединенных атомов. Однако эти диаграммы, отличались от современных отсутствием разрыхляющих состояний. В этом состоит ограниченность подхода Леннард-Джонса, связанная, по нашему мнению, с не вполне правильным пониманием работы Гайтлера и Лондона. В самом деле, исключая разрыхляющие одноэлектронные состояния, Леннард-Джонс исходил из того, что они порождаются одноэлектронными состояниями атомов, одно из которых (или оба) дважды занято, тогда как по Гайтлеру и Лондону взаимодействие таких состояний не должно способствовать образованию химической связи. Однако этот аргумент нельзя признать справедливым по крайней мере по двум причинам.
- Одноэлектронные уровни характеризуют энергию отдельных электронов, но не полную электронную энергию молекулы, которая отлична от суммы одноэлектронных. Взаимодействие замкнутых электронных оболочек приводит к расщеплению соответствующих одноэлектронных уровней, и хотя это расщепление практически не приводит к упрочению химической связи, оно может проявляться в спектрах молекулы.
- Безусловно, ошибочным является исключение из рассмотрения разрыхляющего уровня, когда он заполнен только одним электроном, т. е. предположение о невозможности образования трехэлектронных связей, характеризуемых диаграммой вида
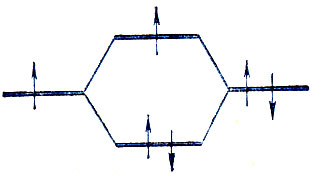
Существование таких связей с точки зрения простого метода Гайтлера-Лондона невозможно, но в действительности они реализуются (например, в ионе Не+2 и т. п.).
Историческая роль работы Леннард-Джонса состоит в том, что, во-первых, сопоставление одноэлектронных состояний в молекуле с соответствующими одноэлектронными состояниями разъединенных атомов и приписывание молекулярным электронам квантовых чисел образующих молекулу атомов заложило фундамент для развития метода МО ЛКАО - основного метода современной квантовой химии. Во-вторых, Леннард-Джонсом была высказана идея о разделении всех молекулярных электронов на электроны внутренних, замкнутых атомных оболочек и валентные электроны, определяющие в основном химические свойства молекулы аналогично тому, как это делалось в методе ВС. Эта идея используется, в частности, в современных полуэмпирических методах квантовой химии.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'