
Почему образуется химическая связь?
Традиционно образование химической связи объясняют понижением потенциальной энергии при сближении атомов, которое превосходит повышение кинетической энергии, так что алгебраическая сумма этих двух величин оказывается отрицательной. Однако, как было показано Рюденбергом [21], в действительности дело обстоит сложнее. По мнению Рюденберга, образование химической связи обусловлено преимущественно понижением кинетической энергии электронов вследствие их большей делокализации в молекуле, чем в невзаимодействующих атомах. Более детальный анализ проблемы был проведен Годдардом и Уильсоном [44] на примере молекулы водорода с использованием обобщенного метода ВС. Согласно этому методу, двухэлектронная функция молекулы Н2 может быть записана с точностью до нормировочного множителя в виде
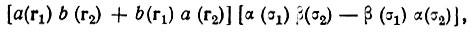 (4.102)
(4.102)где а(r) и b(r) - неортогональные молекулярные орбитали, оптимизированные для каждого межъядерного расстояния R.
При этом энергия обменного взаимодействия атомов водорода (Ех) может быть представлена как сумма кинетической (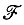 х) и потенциальных ядерной (Vnx) и электронной (Vех) составляющих:
х) и потенциальных ядерной (Vnx) и электронной (Vех) составляющих:
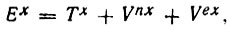 (4.103)
(4.103)где
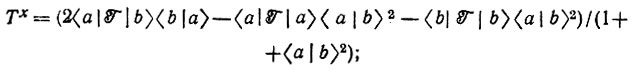 (4.104)
(4.104)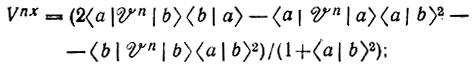 (4.105)
(4.105)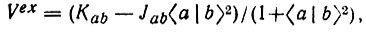 (4.106)
(4.106)
- оператор кинетической энергии электронов; Vn - оператор потенциальной энергии ядер; Каb, Тab - обменный и кулоновский интегралы.
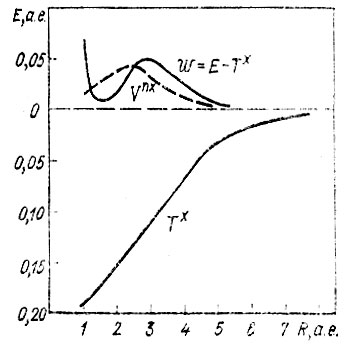
Рис. 26. Отдельные компоненты полной энергии молекулы Н2 как функци межъядерного расстояния (по Годдарду)
Оказывается, что из Ех можно выделить члены, отвечающие за образование связи. Из рис. 25, на котором изображены полученные Годдардом кривые зависимости величин Tx, Vnx, а также разности w = E - Tx от R, видно, что единственной отрицательной составляющей обменной энергии является Тх, причем ее понижение относительно ТR=∞x превосходит соответствующее изменение прочих составляющих энергии (Δw.) Чтобы объяснить этот факт, перепишем выражения для Tx и Vnx в следующем виде:
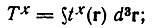 (4.107)
(4.107)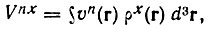 (4.108)
(4.108)где "обменная матрица плотности"
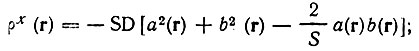 (4.109)
(4.109)vn - потенциал ядер и локальная кинетическая энергия
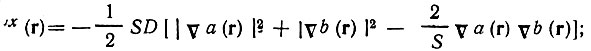 (4.110)
(4.110)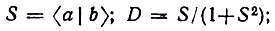
 - оператор градиента.
- оператор градиента.
Существенным является то, что в то время как в выражение для "обменной" матрицы плотности входят произведения орбиталей а(r) и b(r), величина tx включает градиенты этих орбиталей. Если обе орбитали в области связи имеют одинаковые знаки, то можно ожидать, что величина ρx будет мала в этой области вследствие частичной компенсации членов в квадратных скобках. Для величины tx, напротив, следует ожидать большого по абсолютной величине и отрицательного значения. Действительно, в области связи одна из орбиталей убывает, в то время как другая - возрастает, и градиенты этих орбиталей имеют различные знаки. Поэтому каждый член в квадратных скобках формулы (4.110) будет положительным.
До сих пор речь шла о низшем синглетном состоянии молекулы водорода. Для этого состояния ρх в области связи положительна (хотя и мала). Для триплетного состояния, соответствующего отталкиванию ядер атомов водорода без образования ими стабильной молекулы, можно показать, что величина ρх отрицательна. Это создает иллюзию, будто причиной образования молекулы является увеличение электронной плотности между ядрами. Такая точка зрения ие соответствует, однако, действительности. Следуя Годдарду, мы показали выше, что причиной образования химической связи правильнее считать благоприятную конградиентность орбиталей, реализующих связь. Однако следствием благоприятной конградиентности являются также положительные значения ρx. Иначе, концентрация электронной плотности в области связи, уменьшение локальной кинетической энергии в этой же области и образование стабильной молекулы являются следствиями одной и той же причины - благоприятной конградиентности орбиталей.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'