
Электролиз в стакане
Опыты с электричеством еще не раз встретятся вам в этой книге. Сейчас - самые простые. Чтобы провести их, достаточно трех-четырех батареек для карманного фонаря.
Вообще-то опыты по электрохимии часто пытаются ставить дома, но не всегда они выходят: какая-нибудь мелочь и ничего не получается. Если вы будете следовать всем нашим указаниям, можете быть уверены, что опыт удастся.
Электролиз в стакане
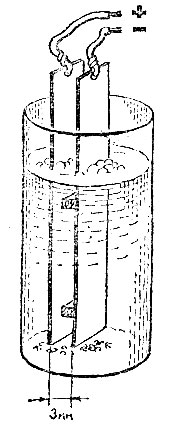
Начнем с очень простого, но тем не менее поучительного опыта. Для него понадобится один-единственный реактив; .чернила любого цвета. Правда, придется немного потрудиться над прибором.
Возьмите два металлические полоски длиной 8-10 см и шириной 1-2 см. Они могут быть из железа, меди, алюминия - безразлично, лишь бы свободно проходили в прозрачный сосуд - высокую мензурку или большую пробирку, Перед опытом просверлите в пластинах с одной стороны отверстия для прикрепления проводников. Приготовьте две одинаковые, толщиной буквально в несколько миллиметров, пластмассовые или деревянные прокладки и склейте их с металлическими полосками так, чтобы те, расположившись параллельно, не касались друг друга. Клей годится практически любой - БФ, "Момент" и др.
В мензурку или пробирку налейте воду и капните в нее столько чернил, чтобы раствор не был очень насыщенного цвета (однако он не должен быть и прозрачным). Опустите в него конструкцию из двух полосок, соедините их проводками с двумя батарейками, подключенными последовательно, "плюс" к "минусу". Несколько минут спустя, чернильный раствор между пластинками станет светлеть, а на дне и вверху будут собираться темные частицы.
В состав чернила входят очень мелкие окрашенные частицы, взвешенные в воде. Под действием тока они слипаются и не могут уже плавать в воде, а опускаются на дно под действием силы тяжести. Понятно, что раствор при этом становится все более и более бледным.
Но как же частицы попали наверх? При действии тока на растворы нередко образуются газы. В нашем случае газовые пузырьки подхватывают твердые частицы и уносят их наверх.
Электролиз в стакане
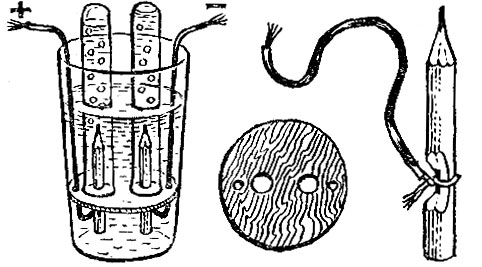
В следующем опыте толстостенный чайный стакан, расширяющийся кверху, будет служить электролитической ванной. Приготовьте фанерный кружок такого диаметра, чтобы он прижался к стенке стакана в трех-четырех сантиметрах выше дна. В кружке заранее просверлите два отверстия (или вырежьте в нем по диаметру прорезь), неподалеку шилом проколите два отверстия: через них будут проходить проводки. В большие отверстия или в прорезь вставьте два карандаша длиной 5-6 см, очиненные с одного конца. Карандаши, точнее, их грифели, будут служить электродами. На неочиненных концах карандашей сделайте зарубки, чтобы обнажились грифели, и примотайте к ним оголенные концы проводков. Проводки скрутите и тщательно обмотайте изоляционной лентой, а чтобы изоляция была совсем надежной, лучше всего спрятать проводки в резиновых трубках. Все детали прибора готовы, остается только собрать его, т. е. вставить кружок с электродами внутрь стакана.
Поставьте стакан на тарелку и налейте в него до краев раствор стиральной кальцинированной соды Na2CO3 из расчета 2-3 чайные ложки на стакан воды. Таким же раствором заполните две пробирки. Одну из них закройте большим пальцем, переверните вверх дном и погрузите в стакан так, чтобы в нее не попал ни один пузырек воздуха. Под водой наденьте пробирку на электрод-карандаш. Точно так же поступите со второй пробиркой.
Батарейки - числом не менее трех - нужно соединить последовательно, "плюс" одной к "минусу" другой, а к крайним батарейкам подсоединить проводки от карандашей. Сразу начнется электролиз раствора. Положительно заряженную ионы водорода Н+ направятся к отрицательно заряженному электроду - катоду, присоединят там электрон и превратятся в газ водород. Когда у карандаша, подсоединенного к "минусу", соберется полная пробирка водорода, ее можно вынуть и, не переворачивая, поджечь газ. Он загорится с характерным звуком. У другого электрода, положительного (анода) выделяется кислород. Наполненную им пробирку закройте пальцем под водой, выньте из стакана, переверните и внесите тлеющую лучинку - она загорится.
Итак, из воды H2O получился и водород Н2, и кислород O2; а для чего же сода? Для ускорения опыта. Чистая вода очень плохо проводит электрический ток, электрохимическая реакция идет в ней слишком медленно.
С тем же. прибором можно поставить еще один опыт - электролиз насыщенного раствора поваренной соли NaCl. В этом случае одна пробирка наполнится бесцветным водородом, а другая - желто-зеленым газом. Это хлор, который образуется из поваренной соли. Хлор легко отдает свой заряд и первым выделяется на аноде.
Пробирку с хлором, в которой находится также немного раствора соли, закройте пальцем под водой, переверните и встряхните, не отнимая пальца. В пробирке образуется раствор хлора - хлорная вода. У нее сильные отбеливающие свойства. Например, если добавить хлорную воду к бледно-синему раствору чернил, то он обесцветится.
При электролизе поваренной соли образуется еще одно вещество - едкий натр. Эта щелочь остается в растворе, в чем можно убедиться, капнув в стакан возле отрицательного электрода немного раствора фенолфталеина или самодельного индикатора.
Итак, мы получили в опыте сразу три ценных вещества - водород, хлор и едкий натр. Именно поэтому электролиз поваренной соли так широко используют в промышленности.
С помощью тока и насыщенного раствора поваренной соли можно проделать еще один занимательный опыт. Займемся сейчас тем, что будем сверлить металл обыкновенным карандашом,
Приготовьте в чайном блюдце насыщенный раствор поваренной соли. Соедините проводком лезвие безопасной бритвы с положительным полюсом батарейки для карманного фонаря (лезвие будет анодом). На заточенном конце карандаша, обломайте грифель и примерно на полмиллиметра выковыряйте его иголкой. На 2-3 см выше сделайте ножом зарубку до грифеля и намотайте на нее конец оголенного провода; это место оберните изоляционной лентой, а другой конец провода присоедините к отрицательному полюсу батарейки (карандаш будет катодом).
Положите лезвие в блюдце о раствором и коснитесь карандашом-катодом лезвия. Тотчас вокруг карандаша начнут бурно выделяться пузырьки водорода. А лезвие-анод будет растворяться: атомы железа приобретут заряд, превратятся в ионы и перейдут в раствор. Так минут через десять-пятнадцать в лезвии получится сквозное отверстие. Особенно быстро оно образуется, если батарейка новая, а лезвие тонкое (0,08 мм). В алюминиевой же фольге отверстие просверливается буквально за секунды.
Если вы захотите просверлить карандашом отверстие в определенном месте тонкой металлической пластинки, то лучше заранее покрыть обрабатываемую деталь лаком, а там, где вы будете сверлить, лак снять.
Углубление в грифеле понадобилось затем, чтобы грифель не касался металла. Иначе цепь сразу замкнется, ток не пойдет через раствор и никакого электролиза не будет.
Сверлить карандашом можно и без электролитической ванны (в нашем случае, без чайного блюдца). Пластинку-анод положите на доску или на тарелку, капните воды, обмакните карандаш, присоединенный к батарейке, в соль и погрузите заточенный его конец в каплю. Время от времени удаляйте тряпочкой продукты электролиза и наносите новую каплю. Повторяя эту операцию, можно, не прикладывая усилий, просверлить металлическую фольгу или жесть от консервной банки. Так же, между прочим, можно сделать отверстие в сломанном стальном ноже, чтобы приделать к нему новую ручку.
Конечно, для сверления металла толщиной более миллиметра одной батарейки мало - надо включить параллельно несколько батареек или воспользоваться понижающим трансформатором с выпрямителем - например, от детской железной дороги или от прибора для выжигания по дереву. И независимо от источника тока и способа электролиза придется несколько раз менять раствор электролита и хорошо очищать лунку - гвоздем или шилом.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'