
Король пластмасс
Всем известно: для выполнения любой работы нужен подходящий инструмент. В химии основным рабочим инструментом служит реактор. Поэтому можно сказать, что эволюция химических превращений в природе шла по этапам возникновения подходящих реакторов.
В космическом пространстве много неорганизованного вещества: элементарные частицы, кванты лучистой энергии, отдельные ядра и целые атомы, не связанные друг с другом. Инструментом, реакторами для превращения их в тяжелые атомы и простейшие вещества служат звезды и планеты. Массовое производство тяжелых атомов идет в звездах, их превращение в окислы, сульфиды, карбиды, некоторые соли - в недрах и на поверхности планет. Первый инструмент обеспечил первую химическую реакцию - реакцию присоединения. В расплавах и концентрированных растворах (новый инструмент) протекают реакции обмена, появляются все новые, все более сложные неорганические вещества.
Пора бы переходить к синтезу органических соединений, но нет подходящего реактора. В атмосфере бушуют грозы, поглощаются ультрафиолетовые лучи, синтезируются окислы азота и азотистые основания. В недpax первобытной планеты карбиды реагируют с водой - выделяются углеводороды. Они окисляются в спирты, альдегиды, карбоновые кислоты. Тут в игру вступает новый инструмент - первобытный океан. В этом огромном реакторе встретились азотистые основания и карбоновые кислоты, полным ходом пошли реакции конденсации, возникли первые аминокислоты и полипептиды.
Потом углеводородные капли в водной среде покрываются оболочкой из аминов и кислот. Прародительница живой клетки (новый инструмент!) отделена от окружающей среды оболочкой-мембраной. Законы осмоса позволяют этой праклетке вбирать из окружающего пространства "питательные вещества", усложнять свое химическое строение, постепенно превращаться в настоящую живую клетку.
Живая клетка - миниатюрное и немыслимо сложное чудо природы. По сей день самые могучие научные коллективы не в состоянии в своих лабораториях и научно-исследовательских институтах воспроизвести и сотой доли химических реакций, протекающих в одной-единственной клетке. От простейшего присоединения и ионного обмена до сложнейшей поликонденсации альдегидов в углеводы, углеводов в полисахариды, аминокислот матричным путем в белки. А ведь там идут еще и реакции разложения, деструкции. Вот уж поистине диалектический подход: разрушать, чтобы создавать.
Все многообразие существующих и существовавших живых организмов - амеба и бронтозавр, ландыш и секвойя, вирус гриппа и человек - может существовать, развиваться, размножаться лишь потому, что они осуществляют непрерывный обмен веществом и энергией с окружающей средой. Делают они это с помощью химических реакций присоединения и разложения, ионного обмена и конденсации, поликонденсации и... Стоп! Полимеризации в природе не было, потому что до недавних времен не было подходящего инструмента.
Такое заявление может вызвать недоумение читателя. Ведь природных полимеров великое множество, как же это могло образоваться без полимеризации? Дело в том, что существуют два принципиально разных пути от низкомолекулярных соединений к высокомолекулярным: реакции полимеризации и поликонденсации. Поликонденсация обычно протекает сравнительно медленно, постепенно, от мономера к димеру, потом к тримеру, потом к тетрамеру и т. д. Эта реакция не очень чувствительна к примесям; каждый из промежуточных продуктов устойчив и может "дожидаться", пока не найдет себе подходящего партнера для дальнейшего роста. Полимеризация же происходит только в среде Очень чистого мономера, когда туда попадает активный агент-инициатор, и сразу доходит до стадии высокополимера. Реакция полимеризации очень чувствительна к присутствию примесей, промежуточные продукты неустойчивы.
В природе все происходит стихийно, но в этой стихийности можно проследить и целенаправленность. Как мы с вами только что наблюдали, эволюция вещества в природе шла от простого к сложному. Элементарные частицы группировались в атомы, те - в простые молекулы, потом во все более сложные и крупные. Элементарная логика подсказывает, что следующим этапом химической эволюции вещества должно быть получение синтетических полимеров.
Так оно и произошло. На свет появились полимеры, но все натуральные природные полимеры получались лишь путем реакции поликонденсации. Для реализации реакции полимеризации нужен был новый инструмент, и этот инструмент мог быть и был создан лишь человеческими руками.
Земной шар существует более 4 млрд. лет. Каких только веществ, каких только наисложнейших химических соединений нет на поверхности и в его недрах. Органическая жизнь началась на Земле много миллионов лет назад. Все это время микробы и бактерии, низшие и высшие растения, насекомые, пресмыкающиеся и млекопитающие синтезировали все новые и новые органические вещества. Все мыслимые химические реакции участвовали в образовании этих веществ. Все - кроме реакции полимеризации.
Чуть больше ста лет назад А. М. Бутлеров впервые понял и объяснил, что эта реакция возможна. Проведенная им полимеризация виниловых эфиров послужила примером того, как можно реализовать этот химический синтез. В XX в. начались работы по получению синтетических полимеров сначала в лабораториях, потом в промышленном масштабе посредством принципиально нового инструмента - химической реакции полимеризации.
Каучуки из диенов, органическое стекло из акрилатов или стирола, великолепные пленки из хлористого винила - массу полезных материалов и изделий получили люди из органических соединений с С-С группировкой. Лишь самый простой из таких мономеров, этилен Н2С-СН2, долго не поддавался полимеризации. Это звучит странно сейчас, в 80-х годах, когда годовое производство полиэтилена в мире перевалило за 10 млн. т. Полиэтиленовые изделия стали известны в наши дни всем на земном шаре. Космонавты-лунопроходцы ссыпают пробы лунного грунта в полиэтиленовые капсулы. Домашняя хозяйка покупает шампунь в полиэтиленовом флаконе.
Полиэтилен стал вездесущ, а всего полвека назад ни один даже самый великий ученый не знал, как его получать. Мало того, сама принципиальная возможность полимеризации полиэтилена многим казалась сомнительной. Дело было в том, что по термодинамическим расчетам превращение этилена в полиэтилен - реакция экзотермическая, с тепловым эффектом 22,14 ккал/моль. Но для того же этилена известны и другие реакции: он может превращаться в графит и водород тоже по экзотермическому процессу с тепловым эффектом 11,14 ккал/моль. Самым опасным для полимеризации конкурентом была реакция превращения этилена в метан и графит: ее тепловой эффект 30,44 ккал/моль. Естественно, что последняя реакция кажется самой выгодной, ведь при ней выделяется больше всего тепла. Не удивительно, что скептики предсказывали крах любым попыткам заполимеризировать этилен. Мол, вместо полимера будет получаться смесь метана с углеродом, возможно, с примесью водорода. Но нашлись и оптимисты, которые стали искать, как бы подавить реакции разложения. Уж больно заманчивыми представлялись свойства будущего полимера. Тем более что возможность образования полимера строго доказал Н. Д. Зелинский, получивший ничтожные количества этого полимера пиролизом этилового спирта под давлением около 5000 атм.
В популярной литературе уже много писалось о лауреатах Нобелевской премии немецком химике К. Циглере и итальянском Д. Натта, открывших способ ионно-координационной полимеризации этилена. Действительно, использование металлорганического комплексного катализатора Циглера-Натта позволило перехитрить природу, подавить побочные реакции разложения и превратить этилен в полиэтилен. Однако вспомним, что открытие это сделано в 1953 г., а промышленное производство полиэтилена началось еще в 1939 г, на предприятиях английской фирмы Ай-си-ай, естественно, совсем другим способом.
Здесь мы снова сталкиваемся с термином "подходящий инструмент", но уже в более обычном его значении. Инструментом для синтеза полиэтилена оказались установки особо высоких давлений. Согласно принципу Ле Шателье всякое внешнее воздействие на систему приводит к таким изменениям, которые ослабляют действие этого воздействия. Из трех возможных химических реакций этилена, рассмотренных выше, полимеризация идет с резким уменьшением объема газовой фазы, превращение в метан и углерод - с сохранением того же объема, а превращение в углерод и водород - с двукратным увеличением объема. Будем держать этилен под высоким давлением. Если реакция начнется, то по принципу Ле Шателье она должна будет идти так, чтобы давление упало, т. е. в сторону уменьшения объема. Таким образом, высокие давления направят реакции этилена в сторону полимеризации. Вопрос только в том, как добиться, чтобы реакция началась.
Инициирование реакции полимеризации давно изобретено и тщательно исследовано. Стоит добавить к жидкому мономеру органическую перекись, слегка нагреть - начнется разложение перекиси, получившиеся свободные радикалы будут взаимодействовать с мономером, реакция полимеризации инициирована. Но в случае этилена этот путь осложняется двумя обстоятельствами. Во-первых, у этилена высока критическая температура - 9,9° С. Уже при комнатной температуре невозможно сделать этилен жидким, а тем более при температурах быстрого разложения перекисей. Во-вторых, из-за высоких давлений температура разложения перекиси еще более повышалась, ведь при таком разложении выделяется кислород, а тут уже принцип Ле Шателье действует во вред процессу. Выход мог быть только один: еще больше повысить давление ради более высокой концентрации этилена, повысить температуру ради разложения перекиси и подобрать такую перекись, которая способна эффективно инициировать полимеризацию в этих условиях.
К счастью, именно таким эффективным инициатором полимеризации этилена оказалась его собственная перекись, образующаяся из мономера и кислорода воздуха.
Чтобы рассказать об этом, хватило нескольких минут. А чтобы все эти, в общем-то, простые вещи узнать, пришлось потратить несколько лет. Но вот в один из погожих весенних дней 1936 г. в Государственном институте высоких давлений в специальной установке при температуре 300° С и давлении 3000-4000 атм из этилена с ничтожной примесью кислорода воздуха группа ученых под руководством профессора А. И. Динцеса получила матовые кусочки нового вещества. Это был совершенно необычный материал. Кусочки его ни в чем не растворялись. На них не действовали крепкие кислоты. А при нагревании удавалось вытягивать из этих кусочков тонкие прочные нити. Самым ценным свойством этого полиэтилена оказались его совершенно уникальные электроизоляционные и диэлектрические характеристики. Именно поэтому первым же потребителем полиэтилена стала высокочастотная техника.
Несколько лет назад в печати шел спор о том, кто первым изобрел радиолокатор: физики-теоретики, радиотехники или электротехники? И все как-то забыли о том, что без полиэтиленовых диэлектрических пленок и теоретики и техники были беспомощны, никакая самая интересная радиосхема не была бы реализована. Только благодаря полиэтилену стало возможным создание эффективно действующих радиолокаторов, его с жадностью стали потреблять кабельные и другие заводы.
Интересно отметить, что именно блестящие электроизоляционные свойства и химическая стойкость полиэтилена стимулировали развитие его производства и в Англии, где он был получен приблизительно в те же годы на установке под давлением 3000 атм в виде белого воскообразного материала. Дальнейшие исследования позволили химикам фирмы Ай-си-ай улучшить свойства полиэтилена, добиться получения материала с эластомерными характеристиками и разработать унифицированную конструкцию реактора высокого давления с мешалкой. Уже почти 50 лет все крупнотоннажные производства полиэтилена высокого давления во всем мире, за одним исключением, используют реактор именно этого типа. Массивный однокамерный реактор, котел с мешалкой, способный работать под давлением от 1500 до 5000 атм, стал тем инструментом, который дает человечеству миллионы тонн полиэтилена низкой плотности. Исключением была трубчатка - реактор принципиально иной конструкции, созданный группой профессора Динцеса во Всесоюзном научно-исследовательском институте нефтяной промышленности. Изменение конструкции реактора привело к существенным изменениям структуры и свойств получаемого в нем полиэтилена, но об этом речь пойдет чуть позже.
* * *
Теоретические расчеты сулят полиэтиленовым цепям разрывную прочность до 1400 кг/мм2. На практике удается реализовать в лучшем случае около 0,2-0,3% прочности. Чтобы объяснить такое несоответствие теоретических и практических свойств полиэтилена, потребовалось разработать и доказать целую теорию надмолекулярных структур. Сделали это В. А. Каргин и Г. Л. Слонимский, на что ушло более 20 лет. И еще 20 лет потребовалось, чтобы найти методы, позволяющие приблизить практические свойства к теоретическим.
Оказалось, что прочнее стали полиэтилен может стать лишь тогда, когда его макромолекулы будут распрямлены, расположены параллельно друг другу, без складок, в устойчивой гексагональной структуре, а микрокристаллы точно так же ровно уложатся в крупный монокристалл. В обычном полиэтилене микрокристаллики срастаются хаотично, образуя структуры, называемые шиш-кебаб, или сферолиты, как показано на микрофотографиях (рис. 2). Лишь с помощью особой методики удается заставить полиэтилен кристаллизоваться так, как это показано на рис. 2. Для этого необходимо перерабатывать полиэтилен под давлением 5 килобар, постепенно повышая температуру, на специальном оборудовании, обеспечивающем правильную кристаллизацию (рис. 3). Прочность таких монокристаллов действительно намного ближе к теоретической. Но вся беда в том, что для хорошей кристаллизации прежде всего необходимо, чтобы сами макромолекулы были строго линейными.
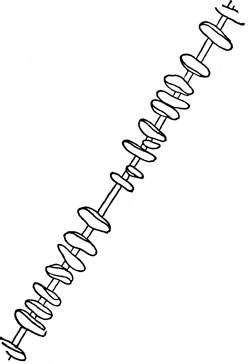
Рис. 2-I. Структура типа шиш-кебаб
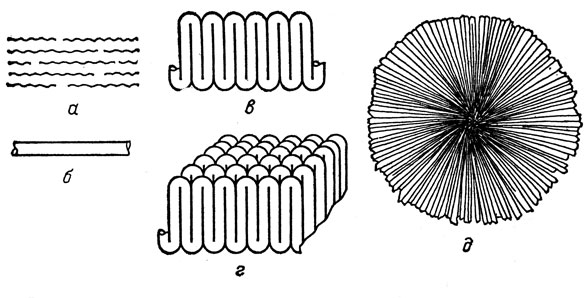
Рис. 2-II. Различные этапы процесса кристаллизации полимера: а) схема пачки макромолекул; б) выпрямленная пачка; в) лента; г) пластина (ламель), составленная из 'лент'; д) схематическое изображение сферолита
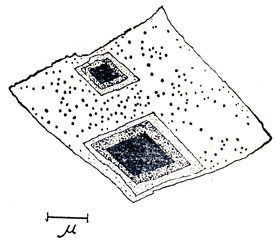
Рис. 3. Монокристалл полиэтилена
Тут-то и таилась главная особенность полиэтилена, полученного методом свободнорадикальной полимеризации при высоком давлении. Растущие полимерные радикалы полиэтилена чрезвычайно реакционноспособны. Хорошо если встретится с таким радикалом молекула мономера: радикал удлинится на одно звено и пойдет искать следующую молекулу. А что, если столкнется он с серединкой другой макромолекулы? Жадный радикал может оторвать от той макромолекулы атом водорода и дезактивироваться. Вместо него на ловлю новых молекул мономера выйдет новый макрорадикал, активный центр которого расположен в середине макромолекулы. В теории полимеризации такое явление называется передачей кинетической цепи на полимер и приводит оно к образованию разветвленных макромолекул. Анализ полиэтилена, полученного при высоком давлении, показал, что в нем такие разветвления обычно разделены десятками, реже сотнями элементарных звеньев. Поэтому мы имеем полное право называть полимер полиэтиленом, не забывая, что истинный полиэтилен имеет несколько иное, более строгое строение. Получать такой строго линейный полиэтилен химики научились лишь в 50-х годах, после открытия Циглером и Натта реакции ионно-координационной полимеризации.
В полиэтилене высокого давления линейные участки кристаллизуются так же, как в линейном полиэтилене. Плотность таких кристаллов около 1,014 г/см3. Вблизи разветвлений образуются аморфные области. В них плотность 0,85 г/см3. Чем больше разветвлений, тем больше аморфной фазы, тем ниже плотность полимера. Плотность полиэтилена, полученного при высоком давлении, обычно около 0,92 г/см3, поэтому его часто называют полиэтиленом низкой плотности. Обычный полиэтилен, полученный методом Циглера-Натта, имеет плотность около 0,95 г/см3, его называют полиэтиленом высокой плотности. У линейных, специально закристаллизованных образцов полиэтилена плотность приближается к 1 г/см3. Одновременно с плотностью в полиэтиленах изменяются прочность, эластичность и другие свойства. Варьируя условия синтеза, можно получать широкий ассортимент полиэтиленов с самыми разнообразными свойствами.
Здесь уместно привести некоторые статистические данные. В 1975 г. в мире было произведено около 12 млн. т полиэтилена высокого давления. 70% этого количества переработано в пленки и трубы, 9% ушло на получение поверхностных покрытий, 3% - на изоляцию для проводов и кабелей, 13% переработано в формованные изделия.
Полиэтилен хорош еще и тем, что у него удивительно высокая химическая стойкость. После 10-12 лет службы изделий из полиэтилена их прочность снижается всего на четверть, да и то ухудшение это связано главным образом со старением самых поверхностных слоев. Прямой смысл собирать изделия, отслужившие 6-7 лет, и подвергать их повторной переработке, добавляя новую порцию противостарителей. Опытная эксплуатация полиэтиленовых труб для телеграфных кабелей из вторичного сырья подтвердила высокую эффективность повторного использования полиэтилена высокого давления. Но все-таки на одном вторичном сырье, как говорится, далеко не уедешь. Нужно создавать, налаживать и осваивать производство свежего полимера. И тут возникает, вопрос: каким оборудованием лучше проводить полимеризацию?
До последних лет общепринятым в Мире для производства полиэтилена высокого давления был вертикальный цилиндрический реактор с мешалкой, сконструированный фирмой Ай-си-ай. Сверху в такой реактор подается этилен под давлением в несколько тысяч атмосфер, внутри работают скоростные мешалки, снизу вытекает расплав полиэтилена. Все просто и удобно. Правда, полимер получается сильноразветвленный, но это никого не удивляет. Передача кинетической цепи на полимер в этих условиях всем представлялась всегда неизбежной.
Иначе взглянули на этот процесс сотрудники НИИНП в Москве и Охтинского химкомбината в Ленинграде. А что, если проводить полимеризацию этилена в длинной трубе, без мешалки? Во-первых, легче будет контролировать и регулировать температуру реакционной массы. Во-вторых, можно в разных местах трубы по мере расходования начального мономера впрыскивать новые порции этилена. Тем самым удается уменьшить передачу цепи на полимер, а значит, удастся получить менее разветвленный и более прочный полиэтилен. На рис. 4 показаны схемы установок трубчатого реактора и реактора с мешалкой и условная структура получаемых в них полиэтиленов. Преимущество трубчатки очевидно. В неё можно по ходу полимеризации вводить в разные зоны другие инициаторы, различные модификаторы и даже другие мономеры. Казалось бы, небольшое изменение конструкции реактора, а дало оно качественный скачок в регулировании свойств получаемого продукта, на порядок расширило возможности получения новых полимерных материалов.
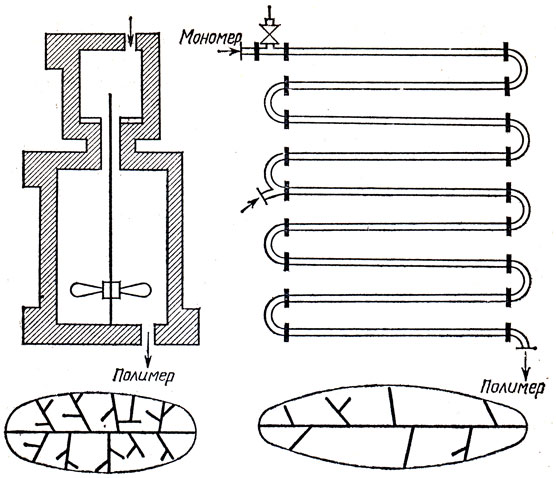
Рис. 4. Схемы классического реактора с мешалкой и трубчатого реактора для производства полиэтилена. Внизу под схемами условно показаны структуры полиэтилена, образующегося в том или ином процессе
К сожалению, в те годы, когда эта конструкция была впервые придумана и в модели опробована, наша страна не имела возможности развернуть широкое применение таких реакторов. Опять, как много раз в этой книге, мы столкнулись с проблемой: где взять подходящий инструмент? В данном случае инструментом должны были стать трубы, способные выдержать давление до 5000 атм. Пока металлурги не научились делать такие трубы, реактор-трубчатка оставался в проекте, а промышленное производство полиэтилена и в нашей стране шло в реакторах-котлах с мешалками. Ведь опыт сооружения паровых и других котлов позволял без особых трудов делать такие реакторы.
Ну а пока металлурги разрабатывали и осваивали производство уникальных труб для сверхвысоких давлений, химики в компании с проектировщиками готовились к строительству мощного полиэтиленового завода, сердцем которого должен был стать трубчатый реактор. Естественно, что такой агрегат имело смысл оснастить самыми современными средствами автоматизации, использовать при его проектировании и строительстве опыт и достижения самых передовых полиэтиленовых предприятий. Во главе этих работ встали охтинское научно-производственное объединение "Пластполимер" и народное предприятие "Лойна-Верке" ГДР. По соглашению 1969 г. Советский Союз взял на себя разработку и изготовление труб и аппаратов сверхвысокого давления, ГДР - арматуру сверхвысокого давления. Вспомогательное оборудование и средства автоматики поделили пополам. Совместный монтаж изготовленных деталей был осуществлен на химкомбинате имени 50-летия БССР в г. Новополоцке. Уникальная промышленная технологическая линия единичной мощностью 50 тыс. т в год дала первую продукцию в 1975 г.
Эта установка - ее назвали "Полимир-50" - потребовала долгой и тщательной настройки. Не удивительно, что на таком сложном инструменте теперь удается разыгрывать целые полимерные симфонии. Одних базовых марок полиэтилена высокого давления установка "Полимир-50" умеет давать целых 17 штук. Прибавьте к этому вариации, в пределах каждой марки. Прибавьте возможность получать сополимеры, в частности, с винилацетатом. Прибавьте еще то, что перестройка с производства одной марки на производство другой происходит автоматически, по единой команде, за считанные часы. Себестоимость получаемого полиэтилена в 1,3-1,5 раза ниже, чем где бы то ни было в мире, а потенциальные возможности установки таковы, что в перспективе ее мощность можно будет довести до 100 тыс. т в год. (Московская правда, 1976. 7 ноября).
По справедливости коллектив авторов, разрабатывавших и создававших установку "Полимир-50", награжден Государственной премией в области науки за 1976 г. Знаменательно и то, что в этот коллектив равноправно вошли ученые и производственники, специалисты по химии, автоматике и тяжелому машиностроению, советские граждане и граждане ГДР. Такой сложный комплексный инструмент мог быть создан и настроен только объединенными усилиями специалистов разных отраслей.
Впервые в истории человечества люди сумели запрячь в одну упряжку достижения столь разных областей, как глубокое понимание работоспособности отдельных молекул, сложных систем автоматического управления и массивных, тяжелых деталей оборудования. Вот это - инструмент для реакции полимеризации!
В самом начале этого параграфа уже говорилось, что полиэтилен в некотором смысле противоестественный полимер. Он не гниет, не ржавеет, не боится кислот и щелочей, он "не по зубам" существующим бактериям и микробам. Полиэтилен очень медленно окисляется кислородом воздуха, и только озон, да еще ультрафиолетовое облучение способны разрушить макромолекулы полиэтилена до осколков, вполне съедобных для гнилостных и других микроорганизмов.
Конечно, можно мобилизовать школьников на сбор полиэтилена, как они собирают металлолом и макулатуру. Можно сжигать это вторичное сырье или перерабатывать его. Но прежде всего надо, наверное, научиться культуре поведения, не разбрасывать обрывки полиэтиленовых, да и других пластмассовых изделий по пригородным лесам. Известно, что проблема уничтожения мусора - одна из тяжелых проблем современных больших городов в капиталистических странах. Производство полимерных материалов у нас в среднем удваивается за пятилетие. Установки большой единичной мощности создаются не только для полиэтилена. Не сегодня-завтра лавина пластмассовых изделий и материалов пригрозит захлестнуть наш быт горами мусора. Уже сегодня нам надо учиться культурному обращению с полимерными материалами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'