
Свойства и особенности элементарного фтора
В Периодической системе Менделеева фтор находится во втором периоде. Атомный вес фтора 19 и атомный номер 9.
Свободный фтор - бледно-желтый газ. Запах фтора резкий и раздражающий, напоминает одновременно запах хлора и озона. По запаху можно обнаружить присутствие одной части фтора в миллионе частей воздуха. Один литр газа при 0°С и нормальном давлении весит 1,71 г.
При низкой температуре (-187°С) фтор конденсируется в жидкость канареечно-желтого цвета.
Жидкий фтор обладает высоким удельным весом. До сих пор во многих литературных источниках и учебниках фигурирует старое (заниженное) значение плотности фтора при т. кип. - 1,108 г/см3. Точное значение плотности фтора - 1,513 г/см3 (при т. кип.).
При обычной температуре, даже применяя высокое давление, фтор невозможно превратить в жидкость - вследствие низкой критической температуры (-129°С). Поэтому при конденсации и хранении фтора не пригодны способы, разработанные для хлора. При -218°С жидкий фтор замерзает в светло-желтое кристаллическое тело, которое ниже -252°С становится бесцветным.
Фтор первый член группы галогенов. По своим свойствам он во многом напоминает их, но, подобно всем первым членам групп других элементов, обнаруживает и значительные отличия. Атом фтора имеет всего два электронных слоя (n=2). Во внутреннем (К-слое) содержится два, а во внешнем (L-слое) - семь электронов. Это сообщает фтору ярко выраженные электроотрицательные свойства. Благодаря нечетному числу электронов во внешнем слое фтор особенно легко присоединяет электрон, превращаясь в отрицательный одновалентный ион.
Фтор обладает рядом особенностей, которые в известной степени объясняют своеобразные свойства его соединений. В первую очередь следует отметить малые размеры атома фтора. Так, его атомный радиус 0,64, тогда как радиус хлора равен 0,99, а радиус йода 1,33 Å. Таким образом, объем атома фтора составляет только одну четвертую часть объема атома хлора и менее одной десятой объема атома йода. Приобретая один недостающий электрон, атом фтора превращается в анион, который также отличается минимальной величиной ионного радиуса - 1,33 Å (соответствующие радиусы хлора и брома: 1,81 и 2,20 Å). Малые размеры атомов позволяют фтору плотно упаковываться вокруг атомов других элементов, в результате чего образуются соединения, богатые фтором и соответствующие высшим валентностям элементов, например: SF6, S2F10, UF6, IF7, OsF8.
Фтор обладает наибольшей реакционной способностью среди неметаллических элементов, его окислительный потенциал выше потенциала озона. Высокая электроотрицательность фтора обусловлена максимальным (по сравнению с другими элементами) сродством к электрону и очень большим потенциалом ионизации. Нормальный электродный потенциал фтора 2,85 в, тогда как для хлора и кислорода эта величина составляет 1,36 и 1,22 в. Если электроотрицательность фтора, выраженную в условных единицах, сравнить с электроотрицательностью некоторых других элементов, получается следующий ряд: фтор (4), кислород (3,5), азот и хлор (3,0), углерод (2,5), литий (1).
Причиной большой реакционной способности атомов фтора является стремление завершить октет внешнего электронного слоя, и сила этого стремления настолько велика, что фтор взаимодействует со всеми веществами за исключением некоторых инертных газов. Все реакции с участием фтора отличаются очень высоким тепловым эффектом. Например, на 1 кг эквимолекулярной смеси лития и фтора выделяется 5650 ккал, бериллия и фтора 4830, углерода и фтора 1830 ккал. При взаимодействии фтора с водородом выделяется 128,4 ккал/моль, тогда как присоединение водорода к кислороду сопровождается выделением только 57,8 ккал/моль.
С кислородом и азотом, которые наиболее близки фтору по своей электроотрицательности, он непосредственно не соединяется. Азот можно использовать как инертный разбавитель при реакциях фтора в газовой фазе. С кислородом фтор соединяется только в электрическом разряде, образуя сравнительно стабильное соединение - дифторид кислорода OF2. Поскольку фтор более электроотрицательный элемент, чем кислород, то в данном соединении атом кислорода заряжен положительно. В этом заключается резкое отличие фтора от других галогенов, образующих с кислородом неустойчивые окислы с отрицательно заряженным кислородом. И вообще во всех соединениях с кислородом фтор имеет отрицательный заряд, поэтому нельзя ожидать образования кислородных кислот фтора, аналогичных кислотам хлора, например, фторноватой HFO3 или фторной HFO4.
Фтор при комнатной и даже при пониженной температуре реагирует с бромом, кремнием, аморфным углем и некоторыми металлами. Тепловой эффект реакции настолько велик, что пламя сгорающих в среде фтора веществ по яркости напоминает кислородно-ацетиленовое пламя или пламя электросварки.
Оригинальность химического поведения фтора и часто удивительные результаты его взаимодействия с другими элементами и их соединениями в известной степени объясняются тем, что он является наиболее электроотрицательным элементом и, входя в состав молекулы, вызывает резкое изменение распределения электронной плотности. Так, введение фтора в неорганические и органические кислоты превращает "их в более сильные кислоты, чем те, которые не содержат фтора. Неорганические фториды азота (трехфтористый азот, тетрафтор гидразин и перфторамины) не обладают основными свойствами. Фтор в любых соединениях имеет отрицательную степень окисления. Только в молекулярном фторе степень окисления равна нулю. Даже в соединении с кислородом F2O фтор имеет отрицательную степень окисления.
Большая электроотрицательность фтора обусловливает возникновение водородной связи во фтористом водороде.
Особенностью молекулы фтора является малая величина энергии связи, равная 37 ккал/моль. Если сопоставить ее с энергиями связей в молекулах других галогенов, то она окажется близкой к энергии диссоциации йода:
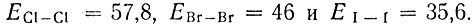
Именно это обстоятельство наряду с большими энергиями связей, образуемых атомом фтора с другими атомами (за исключением азота и кислорода), обусловливает исключительно высокую химическую активность элементарного фтора по сравнению с другими галогенами и неметаллами.
Малая энергия связи в молекуле фтора обусловливает малую прочность молекулы, иначе говоря, -диссоциацию, часто предшествующую химическим процессам. Диссоциация может быть вызвана либо термически, либо фотохимически. Несмотря на небольшую энергию диссоциации связи F - F, необходимы весьма высокие температуры, чтобы молекула фтора заметно диссоциировала. Так, при 300°С степень диссоциации фтора составляет 0,0005, а при 500°С - 0,3%. Однако следует иметь в виду, что при чрезвычайно низкой энергии активации, потребной, например, для отщепления водорода атомами фтора, вероятно, даже такая малая степень диссоциации достаточна, чтобы вызвать в данном случае ценной процесс. Более того, если не принять мер предосторожности, вследствие выделения значительного количества тепла произойдет быстрое разветвление цепной реакции.
Большинство металлов взаимодействует с фтором при обычной температуре, но многие из них образуют стойкую защитную пленку фторида, которая препятствует дальнейшей реакции. Свинец, уран, ванадий реагируют с фтором на холоде. Натрий и кальций в этих условиях воспламеняются. При небольшом разогревании во фторе загораются титан, молибден и вольфрам. С фтором энергично взаимодействуют нагретые металлы платиновой группы. Так, осмий и рутений загораются в атмосфере фтора при 250°С, а платина и палладий - при температуре темно-красного каления.
Очень важным соединением является трехфтористая сурьма- реагент обмена галоидов на фтор. Наиболее простой способ ее получения - растворение трехокиси сурьмы во фтористоводородной кислоте. Не меньшее значение в химии фтора имеют фториды кобальта - дифторид и (мощный фторирующий агент!) трифторид. Последний получают действием фтора на дихлорид или дифторид кобальта при 150°С.
При взаимодействии элементарного фтора с другими галоидами образуются галоидофториды. Известны фториды иода, брома и хлора.
Галоидофториды очень реакционноспособные вещества. В этом отношении они приближаются к элементарному фтору. Трифторид брома, например, взрывообразно реагирует с водой, деревом, резиной и даже асбестом. Наиболее интересное свойство галоидофторидов - их сильное окислительное действие.
Наиболее реакционноспособен трифторид хлора. Он почти количественно превращает хлористое серебро во фторид двухвалентного серебра AgF2 - один из лучших фторирующих агентов. С окислами металлов трифторид хлора образует фториды высшей валентности: например, урановые соединения при реакции с ним количественно превращаются в гексафторид урана.
Алюминий, железо, хром, никель при обычной температуре образуют защитную пленку фторида. Коррозионная устойчивость деталей из этих металлов снижается с увеличением содержания в них углерода, кремния, титана и других легирующих добавок. Из стали можно изготовлять трубопроводы, используемые только при обычной температуре. Однако пленка фторида не всегда защищает металлы от фтора. Серебро и железо загораются во фторе при температуре около 500°С, но "никель, покрытый фтористым никелем, не реагирует с фтором даже при 600°С.
Нагретая вода горит в струе фтора бледно-фиолетовым пламенем, при этом образуется фтористый водород и элементарный кислород:
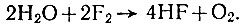
В этой реакции, в отличие от обычных случаев горения, кислород не причина, а продукт горения.
Перфторметан (четырехфтористый углерод) - единственное органическое вещество, которое при обычной температуре не взаимодействует с фтором. Фториды металлов, находящихся в состоянии высшей валентности, также противостоят фтору. Они менее летучи, чем соответствующие хлориды. Для неметаллов наблюдается обратная закономерность (табл. 1).
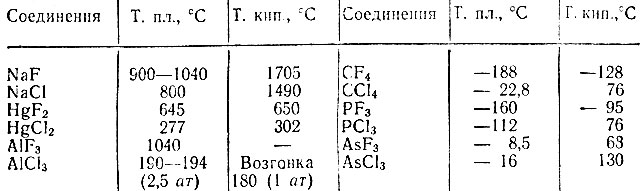
Таблица 1
Фтор имеет только один устойчивый изотоп - F19. Известны радиоактивные изотопы фтора с массами 16, 17, 18, 20, 21, но они имеют настолько короткие периоды полураспада, что практическое применение их, например в качестве меченых атомов, весьма ограничено. При кратковременных опытах, вероятно, может применяться F18, период полураспада которого 105 мин.
До недавнего времени было известно, что атомы инертных, или, как их называли ранее, благородных газов, не склонны принимать или отдавать электроны, что у них нет ни отрицательной, ни положительной валентности и что они не вступают в химические реакции; полностью укомплектованная электронная оболочка лишает эти атомы химической жизни. "Химическая пустыня" - так выглядели инертные газы, составляющие нулевую группу элементов. Но в 1962 г. в этой пустыне были обнаружены признаки жизни!
Барлетт, действуя кислородом на гексафторид платины, получил соединение PtF6O2 и показал, что оно имеет ионное строение [O2]+[PtF6]-. Он предположил, что если гексафторид платины может окислить молекулярный кислород до O+2, то он должен быть способен также превратить ксенон в Хе+, поскольку первые потенциалы ионизации молекулярного кислорода (12, 2 эв) и ксенона (12, 13 эв) практически одинаковыми действительно: при взаимодействии ксенона с гексафторидом платины, который также является газом, Барлетт получил оранжево-желтое твердое вещество, которому было приписано тоже ионное строение [Xe]+[PtF6]. Это вещество сублимируется в вакууме и гидролизуется водой до ксенона, кислорода, фтористого водорода и двуокиси платины. Оказалось, что сравнительно несложными операциями можно осуществить непосредственную реакцию между фтором и инертными газами. Заповедные вещества, которые с молчаливого согласия химиков оставались нетронутыми в течение многих десятилетий, вскоре сделались объектом многочисленных исследований. Достаточно сказать, что за пять лет после работ Барлетта было опубликовано несколько сот исследований, посвященных химии "инертных" газов.
Действуя ксеноном на фтор при 400°С, исследователи получили четырехфтористый ксенон XeF4, представляющий собой бесцветные кристаллы. Это вещество устойчиво при комнатной температуре и плавится около 100°С. Были получены также фторид и гаксафторид ксенона, соединения криптона и радона (KrF4 и RnFx.) и такие вещества, как XeRnF6, XeF2(SbF5).
Тетрафторид и гексафторид ксенона гидролизуются в воде, образуя водные растворы ХеО3. Растворы эти устойчивы, обладают сильным окислительным действием. Описаны соли ксеноновой кислоты - перксенаты: Na4XeO6•2,2H2O, Ba2Xeo6•1,5H2O и др.
Водные растворы перксената натрия медленно выделяют кислород, образуя элементарный ксенон. Многие из соединений ксенона стабильны при обычной температуре, но XeO3, представляющий собой твердое белое вещество, взрывается в вакууме при нагревании до 40°С. Особенностью этих соединений является совмещение в одной молекуле сильно электроотрицательных атомов кислорода и фтора и атомов наиболее тяжелых инертных газов. Легкие инертные газы - гелий и неон, у которых внешние электроны связаны более прочно, не реагируют так легко, хотя не исключено, что некоторые их соединения могут быть получены. Вероятно, химия легких инертных газов будет еще более своеобразной, а методы их получения окажутся не менее оригинальными.
Таким образом, оказалась развенчанной легенда о полной инертности элементов нулевой группы, недавно казавшаяся аксиомой, и подтверждена способность фтора давать соединения со всеми элементами.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'