
"Насущный хлеб" химии фтора
Большие запасы фтора на Земле в виде фторида кальция и фторапатитов позволяют считать, что промышленность, развивающаяся на основе химии фтора, надолго обеспечена необходимым источником сырья.
Простейшим и первым искусственным соединением фтора был фтористый водород - соединение фтора с водородом. Из него впервые был получен элементарный фтор. Значение фтористого водорода продолжает расти, и на его производство обращается особое внимание, так как он является ключевым продуктом промышленности на основе химии фтора. При взаимодействии фтористого водорода с окислами металлов получаются необходимые технике фториды металлов. Фтористый водород служит исходным продуктом для синтеза разнообразных фторорганических соединений. С его помощью из ряда органических соединений вытесняют атомы галогенов к заменяют их на фтор. Он широко используется в процессах электрохимического фторирования и служит основным сырьем для получения элементарного фтора в электролизерах.
Безводный фтористый водород играет важную роль в атомной промышленности, где его используют для получения четырехфтористого урана (восстановлением которого получается металлический уран) и элементарного фтора (с помощью которого тетрафторид урана превращается в гексафторид).
В промышленном масштабе получение фтористого водорода было создано в начале 30-х годов текущего столетия. Фтористоводородная кислота, бывшая сравнительно редким и малодоступным продуктом еще в начале нашего века, теперь стала чрезвычайно важным продуктом, без которого немыслима современная химическая индустрия.
Крупнейшим потребителем фтористоводородной кислоты является алюминиевая промышленность с ее крупнотоннажным производством фторида алюминия и искусственного криолита. За производством алюминия следует промышленность фторуглеродов, вырабатывающая многочисленные органические фториды и нефтеперерабатывающая промышленность, где фтористый водород используют в качестве катализатора для получения высокосортных авиационных топлив. В последние годы выработка фтористого водорода непрерывно возрастает в связи с потребностями атомной энергетики.
Среди водородных соединений галогенов фтористый водород занимает особое место. Его физические свойства скорее можно сравнить со свойствами аммиака и воды, чем галоидоводородов. Температура кипения безводного фтористого водорода (+19°С) намного превышает температуру кипения хлористого водорода (-84°С), так же как температура кипения воды выше температуры кипения сернистого водорода.
Высокая диэлектрическая постоянная и сравнительно высокая температура кипения фтористого водорода указывают на то, что HF представляет собой ассоциированную жидкость. Однако этому противоречат низкие значения поверхностного натяжения и вязкости фтористого водорода. Удовлетворительного объяснения столь противоположным свойствам еще не найдено. Безводную кислоту называют фтористым водородом, а водную, содержащую около 60% HF, - плавиковой кислотой. Оба этих продукта отличаются друг от друга по химическим свойствам, и их следует рассматривать как различные химические реагенты.
Кислоту, содержащую менее 60% фтористого водорода, хранят и перевозят в свинцовой, резиновой или полиэтиленовой таре. При содержании фтористого водорода более 60 %: для этой цели применяют стальную тару. В настоящее время считают более удобным получать безводный фтористый водород, который может храниться в стальной таре, а плавиковую кислоту получать путем разбавления безводного продукта до необходимой концентрации непосредственно перед использованием или перед отправкой потребителю. Этим упрощается проблема хранения.
Безводный фтористый водород получают при взаимодействии кислотного шпата с серной кислотой. Процесс осуществляется в горизонтальной вращающейся печи, в которую подается смесь тонко измельченного плавикового шпата и серной кислоты. Смесь отходящих газов из печи состоит из 95% фтористого водорода, 4% воздуха и примесей (вода, серная кислота, сернистый и углекислый газы). Такая газовая смесь может непосредственно использоваться для получения трех- фтористого алюминия, фторидов металлов и криолита. Для получения безводного фтористого водорода газовую смесь очищают, промывают кислотой, конденсируют и перегоняют. После повторной перегонки и отделения примесей (H2SiF6, H2SO4) удается получить очень чистый (до 99,95%) безводный фтористый водород.
Все соли плавиковой кислоты ядовиты. Сама кислота при попадании на кожу вызывает болезненные, трудно заживающие ожоги. Поэтому, работая с ней, необходимо защищать лицо маской из оргстекла, а руки - резиновыми перчатками.
Совершенно сухой или близкий к этому состоянию фтористый водород почти мгновенно обугливает бумагу. Этой пробой можно пользоваться для быстрого контроля степени обезвоженности. Более точным контролем служит определение электропроводности: у безводного фтористого водорода она ничтожно мала, но даже следы воды и многих других примесей резко повышают ее.
Вообще работа с фтористым водородом требует серьезных мер предосторожности, так как, помимо раздражения слизистых оболочек и ожогов кожи, он вызывает разрушение ногтей и зубов. Кроме того, он способствует отложению кальция в тканях. Средством первой помощи служит 2%-ный раствор хлористого кальция. При ожогах плавиковой кислотой пораженное место следует в течение длительного времени промывать холодной водой, а затем наложить компресс из свежеприготовленной 20%-ной взвеси магния в глицерине.
Свойствами, определяющими химическое поведение фтористого водорода, являются: ярко выраженная кислотность сухого HF и способность его к комплексообразованию, за счет которой он взаимодействует не только с основными, но и со многими кислотными окислами, кислородными кислотами и их солями.
Совершенно сухой фтористый водород реагирует с большинством металлов только при высокой температуре. На золото и платину плавиковая кислота не действует. Существенной особенностью фтористого водорода является взаимодействие его с двуокисью кремния и другими силикатными материалами, входящими в состав стекла и керамики:
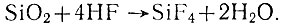
Поскольку фторид кремния легко летучее вещество и на поверхности стекла не сохраняется предохранительной пленки фторида, реакция идет энергично, с самоускорением. Для лабораторной практики важно, что сухой HF крайне медленно реагирует с кварцем.
При действии HF на галоидированные углеводороды происходит замещение хлора на фтор. Эта реакция, открытая Свартсом, требует присутствия катализатора (SbCl3F2 и SbF5) и широко используется в настоящее время для получения фторуглеродных соединений.
Фтористый водород применяется как удобный катализатор многих химических реакций. К ним относятся алкилирование, используемое при получении высокооктановых авиационных топлив, полимеризация, ацилирование и циклизация.
Органические вещества, содержащие кислород, азот и серу, хорошо растворяются во фтористом водороде. Таким образом, катализатор может действовать в жидкой фазе. Фтористый водород не осмоляет и не растворяет насыщенных углеводородов.
Фтористый водород был использован для получения сульфокислот, сульфонов; в нем осуществляется включение окиси углерода в галоидные алкилы и спирты. В присутствии фтористого водорода быстро и энергично нитруются ароматические соединения.
Кремнефтористоводородная кислота H2SiF6 и ее соля (фторсиликаты) находят постоянно расширяющееся применение. Кислота применяется для введения фтора в питьевую воду, для стерилизации оборудования в пивоваренной промышленности. Она используется также в электролитическом получении чистого свинца и гальванопластике, в качестве отвердителя бетона, как антисептик для пропитки древесины, для получения фторсиликатов и фторидов металлов.
Из солей этой кислоты наибольшее значение имеет фторсиликат натрия Na2SiF6. В настоящее время производство его составляет более 30 тыс. т, т. е. почти в три раза больше количества остальных выпускаемых фторсиликатов, вместе взятых. Значительная часть ее используется для фторидизации воды, остальное количество применяется в составе моющих средств, в производстве эмалей, "молочного" стекла и фарфора, при выплавке стали и синтезе криолита. Фторсиликат калия K2SiF6 применяют в составе флюсов для легких металлов при получении эмалей и искусственной слюды. Фторсиликаты магния и цинка употребляются для повышения водонепроницаемости и прочности бетона и известковых растворов. Фторид кальция, образующийся при гидролитическом действии гидроокиси кальция, закрывает поры в строительных материалах.
Фторсиликат бария успешно используется в качестве инсектицида против долгоносика, яблочного мотылька, капустного жука и других вредных насекомых.
Из неорганических фторидов, кроме фтористоводородной кислоты, широкое использование получили трехфтористый бор BF3 и его соединения. Они применяются в качестве катализаторов полимеризации алкилирования, конденсации; по каталитическому действию они близки к серной, фосфорной и фтористоводородной кислотам.
Трехфтористый бор был открыт Гей-Люссаком и Тенаром при попытке получить газообразный фтористый водород из плавикового шпата путем нагревания его с окисью бора в накаленной докрасна железной трубке. В настоящее время трехфтористый бор получают из щелочного фторбората, борного ангидрида и серной кислоты. В обычных условиях трехфтористый бор - бесцветный газ со специфическим острым запахом, температура кипения около -101°С. Температура плавления -129°С, плотность жидкого BF3 при температуре кипения 1,769 г/см3. При обычной температуре стекло устойчиво к действию BF3.
Тетрафторборная кислота находит применение для очистки металлических поверхностей при травлении и гальваническом Покрытии и в некоторых органических синтезах (например, для получения борфторидов диазония при синтезе фторбензола и фтортолуолов). Тетрафторбораты натрия и аммония применяются в производстве натрия и алюминия, выполняя роль ингибиторов окисления.
Одно из необычных свойств многих фторидов - высокая летучесть неионных соединений, причем наиболее летучи из них те, в которых центральный атом соединен с максимальным числом атомов фтора. В соответствии с этим правилом SF4 (Т. КИП. -40°С) менее летуч, чем SF6 (т. кип. -64°С), летучесть AsF5 (т. кип. -54°С) превышает летучесть AsF3 (т. кип. +63°С), OSF8 (Т. кип + 47°С) более летуч, чем OsF3 (т. кип. +205°С). Исключение составляют резко электроотрицательные элементы, например кислород или хлор. В настоящее время известны летучие фториды металлов из семейства актинидов (элементы с номерами 89-96), например шестифтористый уран, превращающийся в газ уже при +56°С. Он был впервые получен из пятихлористого урана и фтористого водорода Руффом, который пытался найти соединение, легко выделяющее элементарный фтор.
Существование летучего фторида плутония предсказывалось на основании сравнения химических свойств плутония и урана. Однако исследователям, наблюдавшим образование шестифтористого плутония при взаимодействии металла с фтором или с фтористым водородом и кислородом, в течение многих лет не удавалось точно охарактеризовать его свойства. Впервые он был получен в 1950 г.:
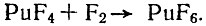
Температура плавления PuF6 +50,8°С, а температура кипения +62,2°С. Шестифтористый плутоний при комнатной температуре представляет собой бледно-коричневое кристаллическое вещество. Он менее устойчив по сравнению с шести-фтористым ураном, вследствие чего является более активным фторирующим агентом. Например, трехфтористый бром фторируется им при 100°С быстрее, чем элементарным фтором. Гексафторид урана в этих условиях не проявляет фторирующего действия.
Исследуется возможность регенерации ядерного горючего, т. е. очистки урана от радиоактивных осколочных элементов, с помощью фторидов. В основу метода положено фторирование облученного в атомном реакторе уранового горючего, а затем отделение урана в виде летучего гексафторида. Фториды радиоактивных продуктов деления, как менее летучие вещества, остаются неперегнанными. Получение UF6 особенно выгодно в тех случаях, когда регенерированный уран направляют на диффузионную установку для обогащения.
Гексафторид вольфрама используется для покрытий вольфрамом графитовых сопел реактивных двигателей. Процесс нанесения металла основан на восстановлении паров шестифтористого вольфрама водородом при 650°С.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'