
Фтор на службе ракетной техники
Расчеты показывают, что фтор в качестве окислителя ракетного топлива по эффективности превосходит кислород.
В принципе для работы ракетного двигателя необходимо рабочее тело (которое также называют "отбрасываемой массой" и "рабочим газом"), создающее реактивную тягу, и источник энергии - для сообщения рабочему телу желаемой скорости.
Ракеты, создающиеся в настоящее время, представляют собой устройства, в которых химические компоненты выполняют обе функции - являются источником энергии и поставляют (в результате реакции окисления) рабочий газ.
Горючим в ракетных двигателях могут быть те элементы или соединения, которые в сочетании с окислителями обеспечивают высокую теплопроизводительность топливной смеси (не менее 1500-2000 ккал/кг) а высокое газовыделение. Элементарный фтор и некоторые фторсодержащие соединения отвечают этим требованиям: из всех известных элементов, способных быть окислителями, только кислород и фтор образуют топливные смеси с высокой теплопроизводительностью.
Применение жидкого фтора в качестве окислителя является одним из перспективных направлений в повышении эффективности ракетных систем. Главное достоинство топлив с окислителем на основе фтора - в высоком значении удельных тяг, скорости горения и в их высокой плотности. Элементарный фтор, являясь самым мощным химическим окислителем, выделяет максимальное количество энергии, причем продукты горения отличаются низким молекулярным весом и малой склонностью к диссоциации при высоких температурах.
Фтор в сочетании с большинством элементов, не считая углерода, способен давать топливные системы с лучшими энергетическими показателями, чем кислород и кислородсодержащие окислители. Кроме высокой энергии связи фтора в образующихся веществах, это отчасти объясняется тем, что фториды имеют более низкие температуры кипения, чем окислы. Температура кипения борного ангидрида 1860°С, а фторида бора - 101°С.
Многие фториды в обычных условиях представляют собой газы, например фториды кремния и бора, в то время как соответствующие окислы элементов - твердые вещества с высокими температурами плавления, что приводит к непроизводительным затратам энергии на нагревание и испарение продуктов горения.
Важное преимущество фтора как окислителя ракетного топлива заключается в том, что со всеми известными горючими он образует самовоспламеняющиеся смеси с низким периодом задержки самовоспламенения. Использование фтора в паре с гидразином позволяет резко уменьшить емкость топливных баков по сравнению с парой кислород - водород. С помощью элементарного фтора можно получить очень высокую удельную тягу, превышающую 400 кг•сек /кг.
Жидкий фтор применяют также в качестве окислителя трехкомпонентных ракетных топлив. В таких топливах горючим служат водород и легкие металлы, например литий или бериллий, а окислителем - фтор. Удельная тяга таких топлив в стандартных условиях может достигать 450 кг•сек/кг.
Наиболее целесообразно использовать фтор в паре с такими горючими, как аммиак, гидразин, водород. Углеродные горючие выгодно использовать со смесью фтора с кислородом. В таком - комбинированном - окислителе горение углеводородов может привести к образованию окиси углерода и фтористого водорода.
Низкомолекулярные продукты сгорания обеспечивают высокое газообразование, что ведет к повышению удельной тяги. Расчетами показано, что смесь окислителей, состоящая из 30% фтора и 70% кислорода, повышает удельную тягу на 20% по сравнению с чистым кислородом. Высокая реакционная способность фтора, ведущая к воспламенению в его среде большинства горючих веществ, обусловлена, с одной стороны, малой величиной энергии, требуемой для разрыва связей в его молекуле, а с другой - большим количеством тепла, выделяющегося при образовании связи между атомом фтора и атомом какого-либо другого элемента, и, следовательно, высокой стабильностью многих соединений фтора. Например, фтористый водород, образующийся при окислении водорода или водород-содержащего горючего фтором, не распадается даже при очень высокой температуре. После молекулы азота молекула фтористого водорода - одна из самых термически стабильных. Таким образом, продукт сгорания водорода во фторе - фтористый водород - по стойкости к диссоциации и термодинамическим свойствам значительно превосходит пары воды, образующиеся при окислении водорода кислородом. Малая степень диссоциации продуктов горения дает возможность повысить коэффициент использования выделяющейся энергии, так как эта энергия не тратится на диссоциацию. Подобно кислороду, фтор является окислителем, который можно конденсировать и хранить при температуре жидкого воздуха. После того как научились сжижать элементарный фтор и перевозить его в специальных контейнерах, построенных по принципу сосуда Дьюара, роль фтора как одного из наиболее сильных окислителей горючего значительно увеличилась. Однако реакционная способность фтора и температура сгорания топлива в его присутствии оказались настолько высокими, что потребовалось разрабатывать специальное оборудование для двигателей и охладительных камер.
Использование фтора для ракетного топлива несколько затрудняется его высокой реакционной способностью, низкой температурой кипения и сложностью транспортирования. К недостаткам фтора как окислителя топлива, следует отнести и его токсичность. Уже в небольших концентрациях (0,008 мг/л) он поражает дыхательные пути. Жидкий и газообразный фтор поражает кожу, вызывая болезненные, долго не заживающие ожоги. Для защиты от фтора применяются фильтрующие или изолирующие противогазы.
До последнего времени считалось, что использование фтора в качества окислительного компонента в первой ступени ракет на жидком топливе сильно затруднено в связи с высокой токсичностью продуктов сгорания. Однако при экспериментальных запусках было установлено, что продукты сгорания очень быстро рассеиваются в атмосфере до безопасных концентраций, не причиняя существенного вреда ни обслуживающему персоналу, ни окружающим предметам. Для устранения вредного действия фтористого водорода, образующегося при работе стендовых двигателей, предусматриваются улавливание и химическая нейтрализация.
Несмотря на все недостатки фтора и многие неприятные и опасные моменты, возникающие при работе с ним, можно предполагать, что этот трудный и богатый своими возможностями элемент в недалеком будущем займет место практически доступного криогенного окислителя высоко-эффективных жидких ракетных топлив.
В числе возможных заменителей элементарного фтора для ракетного топлива в последние годы уделяют внимание соединениям фтора с другими окислительными элементами - кислородом, азотом и галоидами. Все эти соединения представляют собой очень реакционноспособные газообразные или легкокипящие вещества. Судя по многочисленным публикациям, некоторые из этих соединений исследуются в качестве компонентов жидкого ракетного топлива.
Среди возможных заменителей элементарного фтора привлекает внимание окись фтора OF2 (Г. кип. -146,5°С,т. пл. -223,8°С, плотность 1,65 г/см3 при -190°С). Теплота образования окиси фтора 130 ккал/кг. Аналогично фтору его окись обладает сильно выраженными окислительными свойствами. Окись фтора высоко токсичное вещество. При 300°С она распадается на фтор и кислород.
Окись фтора получается при пропускании фтора через раствор щелочи. Как окислитель для ЖРД моноокись фтора занимает промежуточное положение между жидким кислородом и фтором. Она с успехом может применяться в горючем, как содержащем, так и не содержащем углерод.
При этом по плотности и по удельной тяге топливо на основе моноокиси превосходит топливо на основе кислорода.
Топливо на основе моноокиси фтора считают целесообразным использовать в паре с монометилгидразином в ЖРД.
В последние годы внимание исследователей привлекают соединения фтора с азотом. Интерес к этим соединениям вызван их высокой окислительной способностью, объясняемой сравнительно легким отщеплением фтора (энергия диссоциации связи азот - фтор составляет 58-70 ккал/моль). Фториды азота отличаются устойчивостью по сравнению С хлоридами и другими галоидными соединениями азота. Хотя трифторид азота был получен Руффом еще в 30-х годах, интенсивное изучение фторидов азота началось только в начале 60-х годов - со времени получения тетрафторгидразина. Из фторидов азота представляют интерес: трифторид азота (аналог треххлористого азота), тетрафторгидразин, дифтордиазин и дифторамин.
Трифторид азота по своим свойствам резко отличается от взрывчатого хлористого азота и от окиси фтора; он термически устойчив, умеренно активен и не обладает корродирующим действием. Для конденсации его в жидкость и для хранения требуется низкая температура (т. кип. NF3 -129°С). Известны окислительные реакции, позволяющие использовать трехфтористый азот для получения высокотемпературного пламени. Раскаленный древесный уголь горит в трехфтористом азоте более энергично, чем в кислороде. Восстановители, такие, как аммиак и водород, будучи подожжены, горят в трехфтористом азоте с выделением большого количества тепла. Расчетные данные об удельной тяге трехфтористого азота показывают, что он является хорошим окислителем, но не имеет преимуществ перед жидким кислородом.
Известны горелки для резания металла, в которых используются фтор и фторхлориды. В настоящее время сконструирована горелка, работающая на смеси трехфтористого азота и водорода. Трифторид азота используют для сварки металлов, причем нет необходимости в применении флюсов. Трехфтористый азот получается электролизом расплавленного бифторида аммония.
Наиболее изученной реакцией трифторида азота является превращение его в тетрафторгидразин; реакция протекает при повышенной температуре в присутствии металлов или угля, легко соединяющихся с фтором. Промышленное производство тетрафторгидразина осуществляется путем пропускания трифторида азота над углем:
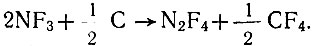
Температура кипения тетрафторгидразина -74°С, плотность 1,5 г/см3 (при -100°С). Химические свойства тетрафторгидразина определяются главным образом его способностью диссоциировать на радикалы NF2. Эта же реакция лежит в основе дифтораминирующего действия тетрафторгидразина,
Дифтораминирующее действие тетрафторгидразина проявляется в при соединении его, например, к олефинам. При этом образуются вицинальные тетрафтордиаминоалканы. Радикал NF2 обладает способностью отрывать атомы водорода от некоторых органических соединений и, становясь на его место, образовывать продукты замещения.
Дефторирование (отнятие фтора) от тетрафторгидразина приводит к образованию дифтордиазина NF = NF. Он может получаться также при фторировании азида натрия и, как побочный продукт, при электролизе бифторида аммония.
Тетрафторгидразин представляет самостоятельный интерес в качестве окислительного компонента жидких ракетных топлив. Благодаря способности к радикализации его можно использовать как катализатор полимеризации некоторых мономеров в газовой фазе.
Недавно получен второй из трех теоретически возможных фторзамещенных аммиака - дифторамин HNF2; первым был трифторид азота NF3.
Дифторамин еще мало изучен. Основные сообщения о нем касаются преимущественно физических свойств и методов получения, в то время как химические свойства, из-за крайней опасности работы с ним, только начинают исследоваться.
Дифторамин получают действием серной кислоты на водный раствор дифтормочевины. Дифторамин в жидком и особенно в твердом состоянии исключительно чувствителен к механическим воздействиям. При детонации в жидком состоянии он не уступает нитроглицерину.
Большое количество исследований, посвященных изучению фторидов азота, показывает, что эти соединения заслуживают большого внимания с точки зрения развития теоретических представлений и вместе с тем имеют Значение как источники химической энергии, а также как исходные вещества для синтеза новых интересных препаратов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'