
Проблемы химического соединения в трудах Д. И. Менделеева
Успехи научной теории обеспечиваются тогда, когда она опирается Не только на конкретные факты, но и на измерения. В химии такого направления старался придерживаться М. В. Ломоносов, подчеркивая роль физических исследований и математической обработки полученных результатов. Действительно, такой метод позволял не только объяснять факты, но и предвидеть новые.
В течение всего XIX в., начиная с работ Д. Дальтона, в химии осуществлялось изучение взаимосвязи свойства - состав - строение. Важнейшую роль в развитии учения о химическом соединении сыграла атомно-молекулярная теория. Особых успехов добилась органическая химия (применялось понятие "молекула", создана теория химического строения А. М. Бутлерова), и уже во второй половине XIX в. началась разработка стереохимии органических соединений.
Неорганическая химия развивалась по-иному, что объясняется объективными трудностями как в применении понятий атомно-молекулярного учения, так и в возможностях неорганического синтеза. В неорганической химии сделать такие значительные шаги, какие сделала органическая химия, оказалось возможным лишь в конце века с развитием теории электролитической диссоциации, созданием стереохимии. На этой основе началось формирование физической химии и ряда областей неорганической химии (химия комплексных соединений, химия силикатов, металлохимия).
Наряду с понятием "вещество", или "тело", в химии первой половины XIX в. получили развитие понятия "атом" и "молекула". Однако учения о составе, строении и свойствах соединений были развиты не в одинаковой степени. Основные объекты химии - атомы, молекулы и кристаллы были изучены как бы на разных уровнях. Количественно могли быть измерены свойства макротел, а свойства атомов вычислялись исходя из некоторых гипотез о строении таких макротел.
Особое место в химии того времени занимало обсуждение понятия "химическое соединение", что объясняется успехами атомно-молекулярной теории и развитием кристаллографических представлений.
Внедрение новых понятий и воззрений, которые формировались на базе многочисленных открытий в первой половине XIX в., было процессом сложным и противоречивым. Так, вместо использования атомно-молекулярной теории пытались (Л. Гмелин) объяснить законы стехиометрии, опираясь на понятие об эквивалентах; в изучении зависимости химических свойств соединений от состава ученые следовали либо дуалистической теории Я. Берцелиуса, либо унитарной теории, Ш. Жерара. Еще ранее в вопросе о составе соединений также существовали противоположные точки зрения (дискретность состава - Ж. Пруст и непрерывность состава - К. Л. Вертолле).
Существовало немало проблем, которые были порождены различными противоречиями, неизбежно появляющимися в ходе развития науки. Перечислим те проблемы, на которые в 50-60-е годы обратил внимание Д. И. Менделеев.
Так, под химической активностью понимали окислительно-восстановительную активность - самый, казалось бы, распространенный случай химического поведения элементов в условиях нашей планеты. ("Химический мир" нашей планеты не случайно называют миром кислорода и воды.) Щелочные и щелочноземельные металлы, как известно, являются столь хорошими восстановителями, что, окисляясь, легко дают оксиды или гидроксиды. Эти прочные соединения, называвшиеся издавна "землями", химики долго не могли разложить на исходные простые вещества, пока им на помощь не пришел могущественный метод "принудительной" передачи электронов: электрохимическое разложение или разложение под действием электрического тока.
Столь же ярко выраженную, хоть и противоположную по проявлению, активность имели кислород и галогены. Они являются ярко выраженными окислителями. Но с изучением все большего и большего числа органических соединений оказалось, что углерод, "обделенный" ярко выраженными окислительными или восстановительными свойствами, является прекрасным депеобразователем. Причем углерод образует длинные цепи, которые могут быть ординарными, двойными и тройными.
Такое положение означало практически неограниченную возможность в получении все новых и новых соединений.
Здесь химики столкнулись с таким видом химической активности, как цепеобразование (теперь нередко связи 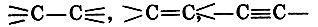 называют гомосвязями).
называют гомосвязями).
В то же время выяснилось, что столь же ярко выраженной способностью к образованию цепей обладает другой элемент - кремний. Однако, в отличие от углерода, кремний образует гомоцепи не столь большой длины, а способен образовывать цепи так же большой длины - гетероцепи, это - силикаты:
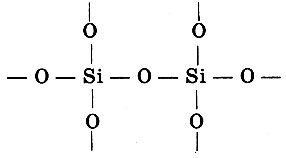
В пространстве они представляют собой соединяющиеся через атомы кислорода тетраэдры (в центре которых - атом кремния). Однако этот вид химической активности надо охарактеризовать не только как склонность к образованию цепей, но и как способность образовывать соединения неопределенного или переменного состава.
Любопытно и другое. Если мы сравним простейшие соединения углерода и кремния

то наблюдаем аналогию состава газообразных соединений углерода (мы знаем их истинную молекулярную формулу), но не можем утверждать аналогии в составе углекислого газа и кремнезема; совпадают только их простейшие формулы. Истинной формулы кремнезема мы не знаем и знать не можем, так как истинную формулу можно найти только для соединений молекулярного строения. Только в этом случае с помощью закона Авогадро или правил эбулио- и криоскопии можно экспериментально установить истинную молекулярную массу соединений.
Еще А. Лавуазье было установлено, что типичные неметаллы образуют только кислотные оксиды, а металлы могут давать не только основные, но и амфотерные и даже (!) кислотные. Осложнялось решение вопроса классификации веществ и их взаимосвязи.
Наконец, неоднозначным было отношение химиков к появившемуся в 1852 г. понятию "валентность". С его помощью Франкланд хотел систематизировать состав соединений. Было замечено, что один и тот же элемент образует соединения одного типа. Речь идет об истинных формулах, например: SnH4, SnCl4, Sn(C2H5)4, т. е. независимо от партнера по соединению число присоединяющихся атомов одновалентного элемента (Н, Сl) или атомных группировок-радикалов (С2Н5) остается постоянным.
Так возникла теория постоянной валентности. Ее стремились приписать и тем элементам, которые не образуют газообразных или летучих соединений. Например, всем металлам, находящимся ныне в побочных подгруппах таблицы Менделеева, была дана как основная валентность два. Между тем состав многих соединений вызывал у химиков, в том числе и у Менделеева, сомнения в справедливости такого подхода.
Все эти проблемы были так или иначе связаны с разработкой систематики (классификации) соединений. Здесь, как и во многих других случаях, предстояло решить, являются ли те или иные свойства индивидуальными, или они принадлежат определенным соединениям и образующим их элементам, или, наконец, принадлежат всем без исключения элементам.
На Химическом конгрессе в Карлсруэ (1860) выявилось наличие двух направлений в изучении взаимосвязи свойств веществ с составом. Центральным понятием первого направления являлось понятие "атом", тогда как второго - "молекула". Следовательно, свойства веществ в первом случае рассматривались как слагающиеся из вкладов, приходящихся на долю каждого из атомов, во втором - определялись из свойств составляющих его молекул. Первое направление наибольших результатов достигло в неорганической химии, второе - в органической. Заслуга С. Канниццаро состояла в том, что он сумел найти единый подход к рассмотрению понятий, одинаково применяемых как в том, так и в другом случае.
Разрабатывая вопросы классификации соединений, Д. И. Менделеев неминуемо должен был подойти к решению более общего вопроса - к классификации элементов. Оба эти понятия - химическое соединение и химический элемент - определили особенности разработки Менделеевым естественной системы элементов. Соотношение между индивидуальными характеристиками атома и более общими характеристиками - свойствами класса соединений - вот что находится в центре внимания Д. И. Менделеева. Так, уже в студенческой диссертации "Изоморфизм в связи с другими отношениями кристаллической формы к составу" (1854) Д. И. Менделеев отмечает, что во времена Гаюи считалось: каждому составу отвечает своя кристаллическая форма. Исключением оказались только так называемые "предельные формы" - такие, как куб, октаэдр, ромбический додекаэдр. В этих формах кристаллизовались различные по составу простые и сложные вещества. "Здесь формы сходны потому,- замечает Д. И. Менделеев,- что они подошли к пределу изменчивости форм" (Соч., т. 1, с. 16).
Таким образом, если А. Лавуазье обобщил результаты изучения свойств элементов на основе химических реакций солеобразования, а С. Канниццаро (см. с. 57) прежде всего провел реформу основных понятий учения о составе простых и сложных веществ (соединений), то на долю Менделеева выпала задача разработать классификацию элементов на основе всей совокупности сведений о составе, свойствах, а иногда - и строении соединений. Анализ формировавшихся и развивавшихся понятий ему приходилось вести с учетом специфики двух основных областей химии - органической и неорганической. С рассмотрения некоторых свойств и явлений, получивших широкое развитие в этих областях,- изоморфизма и удельных объемов - началась научная деятельность Д. И. Менделеева. Первыми элементами, выделяющимися среди других своей индивидуальностью, на которые он обратил главное внимание, были кремний и углерод.
Изучение зависимости свойств их соединений от состава лежало в основе классификаций органической и неорганической химии. Различие в составе (определенные и неопределенные соединения, характерные для - соответственно - химии углерода и кремния), в строении соединений (наличие устойчивых радикалов и гомоцепей, а также ненасыщенных или непредельных соединений в химии углерода и гетероцепей в химии кремния) приводило к существенным различиям и в свойствах большинства соединений указанных двух элементов. Между тем общие формы важнейших бинарных соединений углерода и кремния были тождественны (RO2 и RH4), однако, как уже отмечалось, понятие молекулы было применимо к оксиду углерода (IV) и неприменимо к оксиду кремния (IV).
Один из важнейших вопросов, которым занимался Менделеев в 50-60-е годы, был вопрос о неопределенных соединениях, о том, какие элементы способны их образовать, кроме кремния. Ими оказались, в первую очередь, бор и фосфор.
Говоря о способности разных элементов образовывать соли и подчеркивая неопределенность состава многих соединений, Менделеев отмечал в 1864 г.: "Неопределенные соединения суть соединения по сходству (растворы, сплавы, изоморфные смеси образуются преимущественно сходными телами), а истинные химические соединения суть соединения по различию - соединения тел с далекими свойствами" (Теоретическая химия. Литографированный курс). Тогда же в "Положениях" к защите докторской диссертации (1865) он выдвигал следующий тезис: "Кремнеземистые соединения не суть соли, а относятся к окислам точно так же, как сплавы к металлам".
Анализ архивных материалов показывает, что еще в 1862 г. у Менделеева было намерение изложить неорганическую химию, положив в основу состав наиболее типичных соединений. Однако это намерение осуществить не удалось, так как не было достаточно разработанной классификации соединений.
Рассматривая научную деятельность Д. И. Менделеева 1854-1868 гг., можно сделать следующие выводы об основных чертах и особенностях его научного творчества, что, в свою очередь, позволяет понять, почему именно Менделееву принадлежит такая роль в развитии общей и неорганической химии второй половины XIX в. Эти особенности таковы:
- рассмотрение взаимосвязи всех существующих понятий и выявление главнейших из них;
- всесторонний историко-химический и логический анализ учения о химическом соединении;
- стремление к сопоставлению различных свойств элементов, в особенности количественно измеримых.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'