
Поиски классификации объектов химии (простых и сложных веществ)
На основе изучения кристаллических форм соединений и их связи с составом Д. И. Менделеев пришел к выводу о возможном подчинении индивидуального (состав) определенного соединения общему (одинаковая кристаллическая форма, присущая нескольким соединениям). Действительно, число типов кристаллических форм значительно уступает числу возможных химических соединений.
Изучая явления изоморфизма, Менделеев пришел к другому выводу о соотношении индивидуального и общего: некоторые соединения двух различных элементов оказывались изоморфными. Но эта изоморфность проявлялась не для всех ступеней окисления сравниваемых соединений, а лишь для некоторых. Так, например, оказались изоморфными квасцы состава Me2(SO4)3*K2SО4, а также высшие соединения таких "несходных" элементов, как хлор и марганец (КСlO4 и КМnO4). Было замечено, что образование изоморфных смесей возможно и в ином случае: когда концентрация одного из веществ заметно уступает концентрации другого. Таким образом, здесь потеря индивидуальности могла быть объяснена другими причинами (вплоть до механического включения)*. Наконец, Менделеев обратил внимание на существование "полимерного" изоморфизма Са + Аl вместо К + Si, Менделеев обратил внимание на наличие ряда К2O, Na2O, MgO, FeO, Fe2O3, Al2O3, SiO2, где оксиды поставлены по-степени усиления кислотных свойств. Это положение Менделеев сопроводил таким комментарием: "При замещении группами сумма тел, стоящих по краям, замещается суммою тел, заключающихся между ними" (Соч., т. 25, с. 218).
* (В 1854 г. Е. Раммельсберг показал, что при кристаллизации из смешанных растворов железного и цинкового купороса выделяются кристаллы, характерные для сульфата железа.)
Рассмотрение этих вопросов привело Менделеева к поиску связи между классами соединений или их рядами, имеющими общие формулы. Причину различия между ними он видел в "природе элементов".
В этих условиях понятие "форма химического соединения" приобретало важное качественное и количественное значение. Подобно тому как атомная масса стала мерой качественной и количественной характеристики понятия "атом", так для химического соединения такая мера должна быть выражена по крайней мере через два параметра - молекулярную массу (связанную с формулой) и форму соединения (связанную с химическим строением).
По-видимому, понятие "форма соединения" представлялось Менделееву более удобным для выражения состава неорганических соединений, так как ко многим из них нельзя было применять понятие "молекула", а также найти истинную молекулярную массу и состав.
Менделеевское учение о формах соединений является дальнейшим развитием представления о типах соединений, так как признает равноправие всех составных частей вещества при химических реакциях, индивидуальность соединения. Говоря о целостности соединения, Менделеев подчеркивал, что атомы или их комплексы имеют способность удерживать друг друга и замещать друг друга.
В трудах Д. И. Менделеева особое место отведено рассмотрению реакций замещения (или обмена). В основу классификации Менделеевым положено равенство или различие обменов начальных и конечных веществ. Впоследствии, наряду с изучением объемов реагирующих веществ (газы), Менделеев принимал во внимание изменение тепловых эффектов реакций, сжатие при образовании растворов, изменение объемов при образовании оксидов и хлоридов металлов, теплоемкость и т. п.
Подчеркивая специфику взаимодействия атомов в жидких и твердых веществах, Менделеев указывал на ограниченность применения понятия "молекула" и следующим образом отмечал особенности связи свойств с составом: "...для тел твердых и жидких, в которых частицы сближены - сравнительно с газами и парами - уже должно ждать значительного усложнения, т. е. зависимость свойств от индивидуальных химических особенностей атомов".
Следовательно, понятие "индивидуальность атомов" было призвано отразить особенности строения неорганических веществ на химическом, т. е. качественном уровне.
Любая классификация простых и сложных веществ оказывалась относительной. Для того чтобы установить связь между ними, надо было подняться на более высокую ступень абстракции. Таким абстрактным понятием являлось понятие "химический элемент".
"...Всякий из нас понимает,- писал Д. И. Менделеев в 1869 г.,- что при всей перемене в свойствах простых тел, в свободном их состоянии нечто остается постоянным, и при переходе элемента в соединения это нечто - материальное и составляет характеристику соединений, заключающих данный элемент. В этом отношении поныне известно только одно числовое данное, это именно атомный вес, свойственный элементу. Величина атомного веса, по самому существу предмета, есть данное, относящееся не к самому состоянию отдельного простого тела, а к той материальной части, которая обща и свободному простому телу и всем его соединениям" (Менделеев Д. И. Периодический закон, 1958, с. 17).
Приведем определения понятий "химическое соединение" (1864) и "химический элемент" (1869), которые принадлежат Д. И. Менделееву:
"Химическим соединением вообще называют такое соединение двух или более тел, продукт которого представляется нам однородным, однообразным во всех своих мельчайших частицах".
"Элементы суть материальные составные части простых и химически сложных тел, которые обуславливают их физическое и химическое отношение".
О тесной связи изучения проблемы классификации элементов с классификацией соединений Менделеев писал в статье "О соотношении свойств с атомным весом элементов" (март 1869 г.): "Систематическое распределение элементов подвергалось в истории нашей науки многим разнообразным превратностям. Наиболее распространенное разделение их на металлы и металлоиды опирается как на физические различия, замечаемые между многими простыми телами, так и на различия в характере окислов и соответственных им соединений" (Менделеев Д. И. Периодический закон, 1958, с. 10).
В первых формулировках периодического закона все три понятия - "элемент", "соединение" и "периодичность" - оказались взаимосвязанными ("Свойства элементов, простых веществ, форма и свойства соединений находятся в периодической зависимости от атомных весов элементов"). В этом определении нашел воплощение переход от конкретных свойств, связанных с понятием "химическое соединение", к "коренным", или общим, свойствам, связанным с понятием "химический элемент". "Признают чересчур многое индивидуальным... Связать эти индивидуальности общею идеею - цель моей естественной системы" (Менделеев Д. И. Периодический закон, 1953, с. 618).
Вклад Д. И. Менделеева в учение о химическом соединении определялся, с одной стороны, физико-химическим подходом к рассмотрению свойств соединений, а с другой стороны, методологическим анализом всей совокупности сложившихся понятий. Сочетанием двух этих факторов, опытом работы в различных областях химии, ранней научной самостоятельностью, наконец педагогическими целями отличался Д. И. Менделеев от многих своих современников. Открытие периодического закона и естественной системы как комплексной проблемы оказалось не случайным в творческой биографии ученого.
Изучение особенностей изменения свойств соединений в зависимости от состава и агрегатного состояния в конечном счете и привело Менделеева к открытию общей систематики элементов.
Центральными понятиями этого учения явились понятия о периодичности изменения свойств элементов и о "месте элемента" в системе, свидетельствующие о своеобразии отражения закона в форме системы. Важными категориями, характеризующими взаимоотношения разнообразных свойств элементов, являются здесь категории общего (единого), специфического (особенного) и индивидуального (единичного). Заметим, что эти категории разрабатывались в XIX в. как в естественных (биология, химия), так и гуманитарных (филология, социология, философия) науках.
Под общими свойствами понимаются свойства, прежде всего относящиеся к понятию "элемент" и являющиеся едиными конкретными характеристиками атома как целого. Такие свойства Д. И. Менделеев называл "коренными", и первым из них он считал атомный вес (атомную массу) элемента. "Главное понятие, с которым возможно приступать к объяснению периодической законности, состоит именно в коренном различии представлений об элементах и простых телах" (Менделеев Д. И. Периодический закон, 1958, с. 239). "Понятия и слова простое тело и элемент нередко смешивают между собою...
Простое тело есть вещество, металл или металлоид, с рядом физических признаков и химических реакций... Под именем "элемент" должно подразумевать те материальные составные части простых и сложных тел, которые придают им известную совокупность физических и химических свойств. А потому закон периодичности можно формулировать следующим образом: свойства элементов, а потому и свойства образуемых ими простых и сложных тел стоят в периодической зависимости от их атомного веса" (Менделеев Д. И. Периодический закон, с. 102, 111).
Что же касается свойств соединений, то они могут быть обобщены в рамках определенной совокупности соединений, причем в основу выделения совокупности можно положить разнообразные критерии. Такие свойства будут называться специфическими или особенными (к ним относятся металлические и неметаллические свойства простых веществ, кислотно-основные свойства соединений и т. п.).
Под индивидуальными свойствами в этом случае надо понимать те уникальные свойства, которые отличают два элемента-аналога или два соединения одного класса (например, различная растворимость сульфатов магния и кальция и т. п.). Издавна такие свойства изучались в качественном химическом анализе. Понимая существование причинно-следственных связей между этими понятиями, Менделеев был вынужден заметить: "Периодическая изменяемость простых и сложных тел подчиняется некоторому высшему закону, природу которого, а тем более причину ныне нет еще средства охватить. По всей вероятности она кроется в основных началах внутренней механики атомов и частиц" (Менделеев Д. И. Периодический закон, 1960, с. 384).
Отсутствие необходимых данных о внутреннем строении молекул и атомов заставило Д. И. Менделеева прибегать к рассмотрению таких свойств, которые, выражаясь современным языком, следует считать как модельные (функциональные модели). К числу таких свойств относились атомные и молекулярные объемы*. Эти свойства вычислялись из свойств общих или коренных (атомная или молекулярная масса) и конкретных свойств соединений (плотность простого или сложного вещества). Анализируя характер изменения таких свойств, Менделеев подчеркивал, что закономерности изменения удельных весов и атомных объемов в рядах элементов "нарушаются" теми изменениями в физической и химической природе элементов, которые связаны с количеством атомов, входящих в молекулу, и качеством атомов или формой химических соединений.
* ("Удельные объемы есть понятие собирательное, которое должно быть исключено из науки, когда мы узнаем вес частицы всех тел",- замечает Д. И. Менделеев в диссертации "Удельные объемы" (Соч., т. 1, с. 145).)
Таким образом, такие свойства хотя и были связаны с общими свойствами (атомная масса), но неизбежно оказывались в числе специфических: они отражали объективные различия в природе элементов (теперь это элементы главных и побочных подгрупп).
Говоря в целом о путях рассмотрения свойств в зависимости от состава, Менделеев отмечал в первом издании "Основ химии", что главной задачей является отыскание таких свойств элементов, от которых находятся в зависимости не только физические, но и химические свойства простых и сложных веществ, в частности их способность соединяться с теми или иными элементами, с образованием определенных форм соединений.
Это представление о трех типах свойств, их взаимосвязи между собой и путях отыскания закономерностей общего характера и индивидуальных проявлений лежит в основе учения о периодичности, развитого Д. И. Менделеевым во второй половине XIX в.
Одним из положений этого учения стало объективно существующее (как это теперь известно) представление о двух разрядах сходных элементов. Исторически это представление сформировалось на основе отдельных наблюдений о триадах элементов (Деберейнер) и констатации двух типов взаимосвязи удельных объемов с атомными массами, которые наблюдались у элементов естественных групп (Дюма).
Само изучение взаимосвязи свойств с составом заставило Менделеева анализировать сначала свойства отдельных элементов (что проявилось в изучении изоморфизма, удельных объемов, в сопоставлении свойств углерода и кремния), затем естественных групп (атомные массы и химические свойства) и всех классов соединений (совокупность физико-химических свойств), включая простые вещества.
Толчком к поискам такого рода, как можно судить по двум первым большим работам ("Изоморфизм" и "Удельные объемы"), стали работы Дюма, о которых Д. И. Менделеев писал: "...Дюма, вслед за многими другими, старался найти между величинами паев ... соединений такое же отношение, какое существует для гомологов и аналогов, и успел показать несколько замечательнейших примеров" (Соч., т. 25, с. 115). Впоследствии, в 1884 г., после смерти Дюма, Менделеев отмечал: "...я признаю, что современное положение вопроса об отношениях атомных весов химических элементов определено трудам и идеями Дюма более чем кого-либо другого" (Соч., т. 15, с. 338).
Столь высокая оценка идей Дюма бесспорно связана с тем, что обобщение специфических свойств элементов, приведшее К формированию Менделеевым понятия о двух разрядах сходных элементов, действительно исторически связано со следующими идеями Дюма, в которых отмечены два вида зависимости удельных объемов сходных элементов: малое изменение величин удельных объемов при близких значениях атомных массу одних элементов, значительное различие удельных объемов, меняющееся пропорционально столь же значительным разностям атомных масс,- у других сходных элементов. Иными словами, этими наблюдениями были узаконены два типа сходства по химическим и физическим признакам. Элементы триад или естественных групп формировались по двум большим разрядам:
- элемент-аналоги с близкими атомными массами: Fe, Cu, Ni; Os, Ir, Pt и
- со значительно отличающимися атомными массами: Li, Na, К, Rb, Cs; F, CI, Br, I.
Несомненно имея в виду эти попытки, Менделеев уже в 1857 г. в лекциях по теоретической химии говорил: "Ум наш не может успокоиться в разнообразии, он только там, где единообразие. Естественный метод состоит в определении сходства и различия (НАМ ЛГУ, П-А-7-I-4).
Еще до Менделеева было сделано немало попыток разработать классификацию элементов, каждая из них, однако, еще не давала ключа к открытию систематики элементов, но анализ совокупности подобных работ дал Менделееву возможность по-новому рассмотреть вопрос о типах аналогии в химии. Важно заметить, что Менделеев не ограничивался изучением разностей атомных масс или рассмотрением характера изменения других измеримых свойств всех элементов, в том числе редких. Он стремился охватить всю совокупность свойств элементов и понять причины многообразия возможных их классификаций по составу, свойствам, агрегатному состоянию. Анализируя состояние этого вопроса для классификации органических соединений, он писал еще в 1861 г.: "...Группировка соединений может быть весьма разнообразной, но ни одна система не может выразить... всей последовательности в происхождении и всей аналогии, потому что данное соединение имеет связь не с двумя только соединениями, а с множеством, с одними по гомологии, с другими по аналогии, с третьими по замещению, с четвертыми по типическим реакциям, с пятыми по происхождению и т. д. Геометрически можно выразить сказанное таким образом: всякое изложение представляет линию, а система требует телесной формы" (Соч., т. 8, с. 222).
Одним из важных направлений, по которым шло обобщение свойств элементов, было изучение различий и разнообразия форм соединений, образуемых теми или другими элементами. В этом направлении слились воедино изучение способности образовывать определенные и неопределенные соединения, соединения первого и второго порядка (т. е. так называемых атомных и молекулярных соединений), способности одних элементов к взаимодействию с другими. Если в органической химии такой подход ограничивался предельными формами и тремя-четырьмя элементами, участвующими в их образовании, т. е. насыщенными соединениями, то в неорганической химии разнообразные соединения гораздо труднее поддавались обобщению.
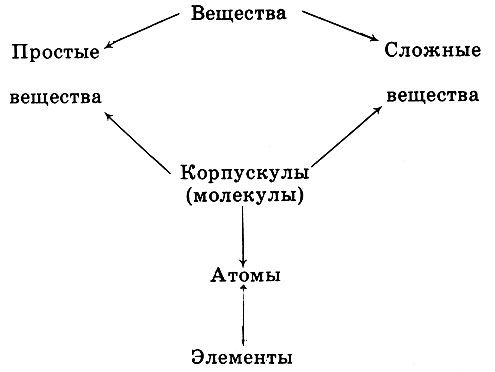
Одна из задач науки - систематизация материала. Так родилось представление о различных классах простых и сложных веществ.
Простые вещества делили - на основании физических свойств,- например их электрической проводимости, на металлы и неметаллы. Сложные вещества можно было классифицировать по составу: бинарные соединения, оксиды, хлориды и более сложные или, как говорили в старину, соединения второго порядка, например хлорид аммония NH4Cl(HCl + NH3). Химики классифицировали соединения и по свойствам, прежде всего таким, как кислотные и основные. (Вы знаете оксиды кислотные, основные и амфотерные.) Другим критерием разделения были окислительные и восстановительные свойства. Когда удалось определить строение соединений, стали пользоваться и такой информацией: предельные углеводороды 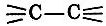 , непредельные = С = С = и т.д.
, непредельные = С = С = и т.д.
Итак, простые вещества и сложные вещества изучали в соответствии с принятыми в науке классификациями: во-первых - по физическим свойствам, во-вторых - по химическим свойствам.
Рано или поздно должна появиться задача - попытаться связать обе классификации: простых и сложных веществ.
В одной из первых приближенных схем утверждалось, что металлам соответствуют основные оксиды, неметаллам - кислотные оксиды. Она оказалась неточной: многим металлам отвечают и гидроксиды, способные выступать в реакциях как кислоты. Тем не менее решение этой проблемы зрело в умах физиков и химиков, начиная с работ Р. Бойля, М. В. Ломоносова и А. Лавуазье. Эти представления можно выразить схемой:
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'