
История открытия периодического закона
Открытие периодического закона - это научный подвиг, который совершил в 1869 г. молодой русский ученый, профессор Петербургского университета Дмитрий Иванович Менделеев.
Каждое открытие - это событие в истории мировой науки. Каждое открытие - это постижение неизвестного, нового, ранее непредвиденного или едва уловимого. Разными бывают по своей значимости и последствиям сделанные учеными открытия. И лишь немногие мы называем революционными. Таковы теория происхождения видов Ч. Дарвина, законы наследственности Г. Менделя, теория относительности А. Эйнштейна, периодический закон Д. И. Менделеева и некоторые другие.
В чем их революционизирующая роль? Прежде всего в том, что они выводили науку на новые рубежи, показывали необходимость принципиально нового подхода к решению поставленных проблем, имели огромное мировоззренческое, методологическое значение, более глубоко и полно раскрывали научную картину мира.
Каждое открытие своеобразно и неповторимо, хотя есть и общие законы научного творчества, но ситуация в науке, "знания эпохи" и "знания ученого", как отмечал в свое время Ф. Энгельс, каждый раз совершенно определенны, они носят индивидуальные, своеобразные черты. Немаловажное значение здесь имеют и философские взгляды ученого - автора открытия.
Почему же открытие Менделеева было расценено, в том числе и Ф. Энгельсом, как научный подвиг?
Прежде всего потому, что Д. И. Менделеев значительно опередил свое время в раскрытии сложной связи, существующей между свойствами конкретных химических соединений (молекул и кристаллов) и важнейшими (или, как он говорил, "коренными") свойствами атомов.
Вспомним, что теория строения атома стала формироваться пятьдесят лет спустя после открытия закона, когда стала создаваться теория спектров (Н. Бор, Д. С. Рождественский, В. А. Фок и др.).
Понять научный подвиг Менделеева мы можем в том случае, если раскроем объяснительную и предсказательные функции периодического закона.
Что же был призван объяснить периодический закон? Прежде всего - характер (еще не причины!) взаимосвязей между элементами. Они угадывались уже до Менделеева. Еще лет за сорок до открытия периодического закона ученые, в частности Деберейнер, отмечали сходство химических свойств некоторых элементов.
Первоначальная мысль - объединить их в триады (закон триад Деберейнера) - не была случайной. Во-первых, она отвечала знаниям о химических элементах - по три "типичных" представителя от многих групп современной системы можно было уже тогда набрать. Число известных элементов и выявленных свойств позволяло это сделать (в начале XIX в. химики знали около 40 химических элементов, только что Дэви получил щелочные металлы).
А во-вторых, вскоре выяснилось, что величины масс атомных элементов подчиняются правилу среднего арифметического:
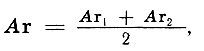
а это означало, что найдена закономерность.
Следующим важным моментом в поисках систематики элементов и в нахождении зависимости свойств от атомной массы было выявление естественных групп сходных элементов.
Формирование этого понятия относится к 1857 г. и связано с именем английского химика У. Одлинга. Это открытие опирается на развитые к этому времени представления о составе соединений, о валентности, о химических формулах. В 50-х и 60-х годах XIX в. проходили острые дискуссии о том, является валентность постоянным свойством или переменным.
Те химики, которые считали валентность постоянным; свойством, хотели верить в то, что атом должен характеризоваться не только постоянным физическим свойством - атомной массой, но и постоянной химической характеристикой - валентностью, т. е. иметь одинаковое число связей с другими элементами в "пересчете" на одновалентный водород. Эти представления были отражены в типических формулах:
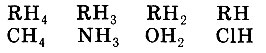
Наиболее характерными соединениями считались соединения элементов с водородом и кислородом. И это не случайно: ведь окружающий нас мир является с химической точки зрения миром кислорода и воды.
Состав газообразных соединений
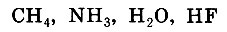
был несложным: на один атом элемента приходилось постепенно уменьшающееся число атомов водорода, т.е. наблюдалась некая закономерная последовательность.
А если продолжить ряд элементов в сторону уменьшения атомных масс? Там стоят
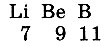
Их летучих водородных соединений химики тогда не знали. Кислородные соединения этих элементов тоже не были газообразными, но если принять валентность кислорода по водороду равную 2, то формулы оксидов всех названных элементов будут таковы:
Li2О, ВеО, В2О3.
То же повторялось, если продолжить написание формул оксидов следующих элементов:
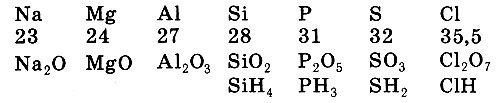
He правда ли, картина повторяется? По составу соединений сходные по химическим свойствам элементы можно расположить в такие ряды:
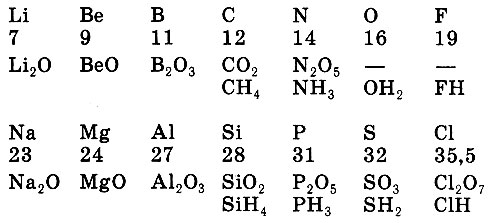
какова разница в атомных массах у сходных элементов?
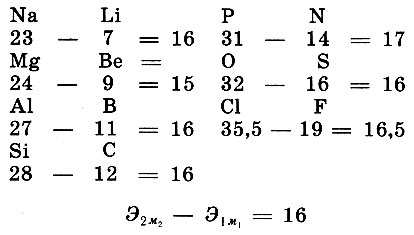
Такая повторяемость не могла являться случайной, она указывала на непознанные еще внутренние закономерности в тех свойствах, которые определяют поведение, свойства атомов, о которых ученые того времени знали еще мало.
1861 г. принес новое тому подтверждение. Р. Бунзен и Р. Кирхгоф в Гейдельберге (Германия) открыли закон, согласно которому каждый химический элемент имеет свой, присущий только ему (т. е. индивидуальный) эмиссионный спектр (спектр испускания). Этот закон положил "начало спектральному анализу - одному из действенных методов обнаружения химического состава изучаемых образцов (минералов и т. п.).
С его помощью было открыто несколько химических элементов: таллий, индий, гелий (на Солнце), позже галлий - элемент, предсказанный Менделеевым, а еще позже доказана индивидуальная природа инертных газов, обнаруженных в атмосфере.
Впоследствии исследование спектров сыграло важную роль в создании теории строения атомов.
Знания о внутреннем строении химических соединений (химической связи) и свойствах атомов химикам середины XIX в. приходилось получать косвенным путем: изучая химические реакции, сопоставляя свойства аналогичных элементов и сходных по составу соединений.
Этот путь познания внутреннего (микроскопического) на основе изучения внешнего (макроскопического) был громоздким, длинным и извилистым. Под давлением новых фактов погибла не одна из ранее высказанных гипотез, не одно остроумное предположение.
Вот одно из них.
Ранее мы рассмотрели легкие элементы (Li-Сl), образующие газообразные водородные соединения и оксиды, изученные уже давно благодаря их практической значимости.
Но ведь их только 14! А остальные элементы? Их было к моменту открытия уже 60... Большинство из них являлись металлами, в том числе редкими, рассеянными, а значит, и плохо изученными.
Возьмем фрагмент современной таблицы, а точнее элементы так называемых вставных декад. Вот первый ряд (взяты известные тогда элементы):
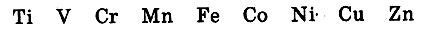
Многие из них человечество тоже знало давно: железо, медь, цинк, хром, марганец.
Все они были металлами, многие тугоплавкими, летучих соединений с водородом не образовывали, зато давали несколько соединений с кислородом
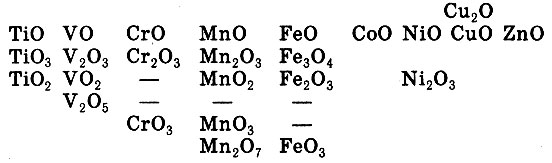
Надо было бы признать у них переменную валентность, но на это сразу не решились. Сочли основной валентностью ту, которая наиболее распространена у них, т. е. 2. Благо и при взаимодействии с кислотами, например НСl, всегда - в момент реакции - получались только соединения состава RCl2. Например: Мn + 2НСl = MnCl2 + H2↑.
Теперь это положение об исключительной двухвалентности металлов побочных подгрупп подверглось уточнению. Получило свое объяснение и наличие у них такого набора соединений разного состава. А в середине XIX в. все соединения, в которых валентность оказывалась выше двух, были признаны за пероксиды - соединения, обладающие ярко выраженными окислительными свойствами, т. е. соединения, легко восстанавливающиеся до "обычных" оксидов. Так, оксид марганца (IV) - одно из популярных в химической практике соединений - относили к пероксидам.
Теперь мы знаем, что элементы побочных подгрупп или - если говорить о рядах, а не о группах - вставных декад имеют свойства, отличающие их от элементов главных подгрупп системы, и это диктуется особенностями их электронного строения.
Заметим сразу, что некоторые ученые уже тогда это понимали. К ним относился, как уже отмечалось, выдающийся французский химик Б. Дюма. Ему принадлежит идея о двух типах элемент-аналогов:
1) химическое сходство проявляется у элементов, имеющих близкие атомные массы:

2) с другой стороны, химическое сходство проявляется у элементов, резко отличающихся по атомным массам. Таковы элементы "естественных групп".

Встала задача Объединить все эти элементы воедино одной классификацией. Нужна была идея, которая легла бы в ее основу.
Предшественники Менделеева пытались найти эту идею, располагая элементы в виде различных таблиц. Таковы спираль французского ученого Б. де Шанкуртуа - спираль по поверхности цилиндра; таблица англичанина Одлинга (1857), отразившая идею Дюма о двух разрядах (типах сходства) элементов; закон октав английского химика А. Ньюлендса; а также таблицы, где элементы располагались по валентности: такова таблица Лотара Мейера, в которой одним элементам не нашлось места, а для других было предложено искусственное решение.
В чем заключались трудности, с которыми столкнулись ученые - авторы первых таблиц элементов?
Если центральной идеей становилась идея расположить элементы в порядке роста атомных масс, то до конца ее реализовать было невозможно по той причине, что атомные массы примерно для третьей части элементов были определены неправильно. Это касалось в основном тех элементов, которые составляют теперь побочные подгруппы. Таковы: Yt, La, редкоземельные элементы, Th, U, платиновые металлы и др.
Относительно элементов будущих главных подгрупп у ученых были различные толкования, например об атомных массах бериллия, индия, что доставило некоторые трудности с размещением этих элементов.
Теллур имел атомную массу большую, чем йод, хотя совокупность химических свойств диктовала иную последовательность в их расположении. И когда говорят теперь, что Менделеев открыл периодический закон, расположив элементы в порядке возрастания атомных масс, то это утверждение не соответствует действительности.
Сравните три строки

которые записаны в соответствии с принятыми тогда величинами атомных масс, с современной таблицей, и вы поймете, " что для такого утверждения нет никаких оснований. Впрочем, таблицы Ньюлендса, Одлинга или Мейера это отчетливо подтверждают, столько в них было искусственного, произвольного. Если же опираться при сопоставлении элементов на их свойства, то возникал вопрос: какие свойства надо положить в основу?
Физические свойства? Точность их определений была невысока, да и различна для разных элементов, ведь многие из них даже не были выделены в виде простых веществ. Металлы? Существовал электрохимический ряд металлов Авогадро, но этот ряд был немногочисленным.
А может быть, положить в основу классификации химические свойства? Но, во-первых, они, как правило, не поддаются количественному измерению, т. е. относительны: таковы кислотно-основные, окислительно-восстановительные свойства.
Во-вторых, эти свойства недостаточно хорошо изучены у редких элементов, а как раз там при близких значениях атомных масс надо знать и минимальные различия в свойствах, чтобы правильно судить о последовательности расположения этих элементов.
В-третьих, обычно принятые понятия химической активности вступали в противоречия с той активностью, которая была характерна для пассивных (в окислительно-восстановительном смысле) металлов: они легко давали очень сложные, так называемые комплексные соединения. Как было разобраться в этой причудливой химической мозаике?
Д. И. Менделеев понял: нужно пересмотреть всю систему химических понятий. Он на первых порах выступил как реформатор. Проведя историко-логический анализ, он разработал иерархию химических понятий. Вот пример такой работы.
Возьмем первую классификацию химических элементов, данную А. Лавуазье (1789). В ней выделены такие элементы, как металлы, дающие основные оксиды, неметаллы и металлы, дающие кислотные оксиды.
С такой трудностью столкнулись и те ученые, которые спустя 50 лет занимались собиранием элементов в естественные группы:
Li, Na, К, Rb, Cs.
Вот щелочные металлы. Они дают основные оксиды.
Вот галогены - неметаллы. Они дают кислотные оксиды.
Вот щелочноземельные металлы. Они дают основные оксиды.
Вот халькогены. Так называли группу кислорода О, S, Se, Те. Они дают кислотные оксиды.
Но вот группа углерода С, Si - Sn, Pb или группа азота N, P, As, Sb, Bi.
Хотелось бы сказать "неметаллы" и добавить "дают кислотные оксиды". Но ведь олово и свинец, сурьма и висмут давно известны как металлы, а их высшие оксиды действительно дают кислоты...
И это только некоторые металлы - те, которые теперь вошли в главные подгруппы системы. А мы уже говорили о металлах, входящих ныне в побочные подгруппы: таких, как хром и марганец, ванадий и железо. Их высшие оксиды также дают кислоты. Например, дают кислоту, подобную серной, Cr, Fe, Mn в степени окисления +6 (ЭO8) - их соли имеют общую формулу К2ЭO4.
Было давно известно, что некоторые соединения изоморфны, т. е., кристаллизуясь, дают изоморфные смеси. Такие изоморфные смеси дают многие соединения...
Какие именно, об этом с точки зрения классификации элементов задумался Менделеев.
Он выполнил эту работу еще будучи студентом Главного педагогического института в 1854 г. В этой работе он дал классификацию видов изоморфных замещений, И самое главное: он показал, что
- изоморфизм является признаком сходства элементов только в определенной степени окисления,
- число химических соединений значительно превосходит число кристаллических форм (изоморфными оказываются соединения,- ничего общего не имеющие в химическом отношении, например СаСO3 и NaNO3).
Пытаясь разобраться во внутренних причинах, побуждающих атомы или их группы к изоморфному замещению, Менделеев стал искать какую-либо характеристику или коренное свойство атомов в соединениях, которые смогли бы помочь количественно описать это явление. К таковым относилась величина удельного объема.
Для того чтобы понять, что это за величина, возьмем несколько примеров.
Атомный объем находится делением атомной массы на плотность простого вещества
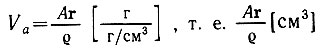
Это объем, который занимает моль простого вещества. Корень кубический из этой величины есть расстояние, принадлежащее атому в соединении, или его радиус, если предположить, что атомы соприкасаются.
Оказалось, что по величинам изменения объемов атомов, вычисленных для простых веществ, и объемов тех же атомов в различных соединениях можно было сделать интересные выводы не только об изоморфизме.
Изоморфные смеси образовывали атомы с близкими значениями атомных (удельных) объемов - Cr, Mn, Fe, Co, Ni, Cu, Zn. Важные выводы можно было сделать и о классификации соединений. Так, типичные соли образовывались со значительным изменением объемов, а молекулярные соединения - почти без изменения объемов. Менделеев называл первый тип проникновением атомов, а второй - соприкосновением.
Следующим этапом было выяснение того, какие формы соединений образуют различные элементы, взаимодействуя с наиболее характерными элементами, такими, как кислород, фтор и хлор. Выбор партнера по реакциям был не случаен.
Прежде всего проверялись окислительно-восстановительные способности простых веществ. Они издавна служили мерилом химической активности.
Оказалось, что атомы элементов в разных степенях окисления и в зависимости от взаимного положения вели себя по-разному. В этом была определенная закономерность.
При этом Менделеев понял и в лекциях по теоретической химии 1864 г. ясно заявил, что, во-первых, химическая активность не является свойством элемента, а зависит от многих причин: степени насыщения, партнера, условий взаимодействия, т. е. от "состояния атома". Так, углерод и кремний равно далеко отстоят от щелочных металлов и галогенов и, с ними реагируя, солей не образуют.. Вместе с тем они проявляют такую активность, которая не характерна для других элементов: способность давать цепи. Углерод дает цепочки из атомов углерода, а кремний - каркас из чередующихся атомов кремния и кислорода. Первые стали символом органического мира и его эволюции, а вторые - минерального мира.
Во-вторых, Менделеев понял, что химические свойства зависят от физического состояния атома: чем выше степень окисления, тем более атом теряет свою индивидуальность и приобретает черты, делающие его сходным с атомами других элементов.
И вот финал. Формируется иерархия понятий. Центральным понятием является понятие "химический элемент". Закон взаимосвязи элементов - особый закон. Он охватывает две идеи: повторение (это было уже у Ньюлендса, хотя и выражено примитивно) и развитие (это тоже было, но еще более упрощенно - у Одлинга).
Менделеев понял, что нужно одной идеей - периодической повторяемости свойств у высших форм соединений - объединить элементы, составляющие те две совокупности сходных элементов, о которых говорил еще Дюма.
Тогда в периодической системе оказались в единстве выраженными две идеи: горизонтального и вертикального сходства, которые на разных участках системы, чередуясь, выражены в разной мере. Каждый ряд, как и группа, имеет свои особенности. Их изучение и составляет предмет неорганической химии.
Каждый элемент сугубо индивидуален, все вместе они составляют закономерный переход этих индивидуальностей. По какому-либо свойству один из них в определенном состоянии (простые и сложные вещества) оказывается самым прочным, высокоплавким, активным и т. д. и т. п.

'Опыт системы элементов...'
Итак, периодический закон позволил не только обосновать научную классификацию элементов и их соединений, но и позволил установить четкую взаимосвязь многих важнейших химических понятий. Развитие неорганической химии с тех пор проходит в рамках учения о периодичности.
Периодический закон позволил предсказать свойства многих еще неоткрытых элементов. Предсказания Менделеева вскоре оправдались. Это был триумф теории. Теперь мы понимаем, почему заслуги Менделеева Ф. Энгельс назвал научным подвигом. С его помощью, а также используя такие достижения физики, как открытия электрона и радиоактивности, Э. Резерфорд, Н. Бор и другие ученые предложили модель атома, разработали теорию строения атома, а затем и теорию химической, связи. Так была решена одна из центральных проблем химии: выяснение связи свойств с составом и строением тех объектов, которые она изучает.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'