
Химические элементы и попытки их классификации до Д. И. Менделеева
Химические элементы
Представления о единой основе всей природы и строении ее тел из нескольких простых веществ известны с весьма давнего времени. Различные философские учения о строении природы отражали стремление объяснить в той или иной мере ее происхождение и многообразие, понять сущность окружающего мира. Наиболее материалистичными были воззрения греческого философа Демокрита, полагавшего, что все природные вещества состоят из мельчайших неделимых и несжимаемых частиц-атомов различной формы и величины, но одинакового состава. Однако значительно шее распространение получило философское учение Аристотеля о первоматерии и ее началах (качествах), сочетанием которых можно получить четыре основных элемента - землю, воду, огонь и воздух. Это учение позже поддерживалось и католической церковью, так как в известной мере оно не противоречило библейским легендам о сотворении мира.
Атомы и элементы, принятые в учениях древних философов в качестве первичной основы строения материи, были, конечно, чисто умозрительными, абстрактными понятиями, никаким опытом не подтвержденными. Несостоятельной была и идея алхимиков о возможности превращения одних элементов в другие, а именно неблагородных металлов в золото, возникшая в средние века.
Новые, более близкие к современным, понятия и терминология, основанные на исследованиях и результатах опытов, появляются в химии только начиная с работ Р. Бойля. В своей книге "Скептический химик" он утверждал, что любая химическая теория может быть принята или отвергнута только на основе наблюдений или опыта. Понятие "элемент" было впервые использовано Р. Бойлем в качестве научного термина в 1661 году.

Роберт Бойль (1627-1691)
"... я теперь понимаю под элементами некоторые примитивные или простые или совершенно несмешанные вещества; эти вещества, не будучи составленными из других веществ или друг из друга, являются составными частями, из которых непосредственно состоят все те тела, называемые совершенными смесями, и на которые последние в конечном результате разлагаются".
Следовательно, под химическим элементом Р. Бойль подразумевает нечто материальное, входящее в состав сложных веществ и не разлагающееся на составные части. По этому поводу Ф. Энгельс писал: "Бойль делает из химии науку".
К 1694 г. в соответствии с определением Р. Бойля было известно 14 химических элементов:
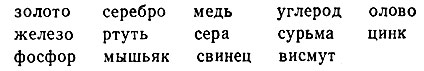
Великому русскому ученому М. В. Ломоносову принадлежит заслуга дальнейшего развития опытных исследований в химии и преобразования ее в точную науку. На основе измерения количеств веществ, участвующих в "химических превращениях" М. В. Ломоносов установил закон сохранения веса вещества, подтверждающий неуничтожаемость материи. На основе представлений об элементах (соответствующих атомам) и собраниях элементов - корпускулах (молекулах) М. В. Ломоносов создал корпускулярную теорию строения вещества во многом совпадающую с современными представлениями атомно-молекулярного учения.
Количественные приемы изучения химических реакций широко использовались и выдающимся французским ученым А. Лавуазье, научная деятельность которого открыла новый этап в развитии химии. Только со времен Ломоносова и Лавуазье процессы взаимодействия веществ стали изучаться в химии количественным методом, позволяющим определять состав химических соединений. При помощи этого метода был открыт еще ряд элементов:


Михаил Васильевич Ломоносов (1711-1765)
Таким образом, к концу XVIII века было достоверно обнаружено существование уже двадцати пяти элементов".
Следует отметить что в учебнике по химии Лавуазье, изданном в 1789 г., впервые была приведена таблица химических элементов и сделана попытка их классификации на основе физических свойств (металлы и неметаллы) и типа образующегося окисла.
Начало XIX столетия ознаменовалось открытием новых очень важных весовые количественных закономерностей, позволяющих определять весовые соотношения между элементами, вступающими во взаимодействие, что сыграло большую роль в развитии атомно-молекулярной теории - основы химической науки.
Разработка атомно-молекулярной теории во многом обязана выдающимся ученым: Дальтону, Авогадро, Жерару, Берцелиусу, Канниццаро и др. Особенно большое значение имели исследования английского естествоиспытателя Дальтона, который на основе атомной гипотезы впервые ввел в химию понятие об относительном атомном весе элементов. Используя результаты анализа различных соединений Дальтон определил веса некоторых элементов, показав тем самым, что это свойство атомов доступно для экспериментальных определений.
В "Диалектике природы" Ф. Энгельс отмечал:
"В химии, особенно благодаря дальтоновскому открытию атомных весов, мы находим порядок, относительную устойчивость однажды достигнутых результатов и систематический, почти планомерный натиск на еще не завоеванные области, сравнимый с правильной осадой какой-нибудь крепости".
"Новая эпоха начинается в химии с атомистики (следовательно, не Лавуазье, а Дальтон - отец современной химии)..."*
* (Ф. Энгельс, Диалектика природы, Издательство политической литературы, 1969, стр. 92, 257.)

Антуан Лоран Лавуазье (1743-1794)
Таким образом, качественное своеобразие химических элементов начинает связываться с их количественной характеристикой - относительным атомным весом, ставшим впоследствии основой классификации элементов. Однако экспериментальное определение точных атомных весов оказалось нелегким делом и нередко давало разноречивые результаты, так как предварительно требовалось установить количественный состав ряда летучих соединений данного элемента, их молекулярные веса и истинные формулы. В то время химики-органики не считались с атомными весами элементов, принятыми неорганиками а многие ученые предпочитали пользоваться "собственными" атомными весами или же эквивалентными весами элементов введенными английским естествоиспытателем Волластоном в 1814 г. Под эквивалентным весом подразумевалось такое весовое количество элемента, которое может соединиться с одной весовой частью водорода или заместить ее. Значения эквивалентных весов, найденные опытным путем, все же вызывали сомнения в их правильности.
С течением времени экспериментальные методы определения атомных весов элементов совершенствовались, становились более точными и приводили к достоверным значениям
В первой половине XIX столетия был открыт еще 31 элемент, т. е. больше, чем за все предшествовавшее время:


Джон Дальтон (1766-1844)
Изучение свойств этих элементов и их соединений, а также синтез ряда соединений элементов, открытых ранее, дали много новых сведений и позволили накопить большой фактический материал, но вместе с тем выявили и необходимость его систематизации. Прежде всего нужно было решить основной вопрос, являются ли химические элементы разрозненными, независимыми "началами" или они закономерно связаны между собой в единую систему.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'