
Попытки классификации элементов. Международный съезд химиков в 1860 г.
Многочисленные исследования, относящиеся к началу и середине прошлого века, привели к установлению сходства химических свойств ряда элементов и некоторых закономерностей в изменении значений их атомных весов*.
* (О специальной литературе, посвященной этим исследованиям, см. стр. 187.)
Так, Деберейнер (1829 г.) ввел понятие о триадах-группах из трех сходных в химическом отношении элементов, в которых величина атомного веса среднего элемента близка к среднеарифметическому значению атомных весов двух крайних элементов. Позже было установлено наличие группировок из большего числа элементов, чем в триадах, например группировка - магний, кальций, стронций, барий (Гмелин); отмечено особое значение в химии чисел 8 и 18, так как разности между эквивалентными весами сходных элементов равны 8 и 18 или кратны этим числам (Петтенкофер). Было замечено также, что элементы, атомные веса которых близки по величине, сходны по химическим свойствам и часто в природе встречаются вместе (Глэдстон), например платиновые металлы (платина, родий, иридий, осмий, палладий и рутений), группа железа (железо, кобальт, никель). Для нахождения атомных весов всех элементов, входящих в данную группу химических аналогов, были предложены общие формулы (Кук, Дюма). Введено понятие об артиадах - четные элементы и периссадах - нечетные (Кук). Дано графическое изображение системы, охватывающей 41 элемент, в которой обращает внимание деление одной группы на две подгруппы: кальцоиды - Са, Sr, Ва и кадмоиды - Zn, Cd, Pb (Гинрихс). Указывалась возможность естественной связи не только между элементами одной триады, но и элементами трех соседних триад (такие группировки были названы эннеадами *) на основе эквивалентных весов (Ленссен).
* (От греческого эннеа - девять.)
Английский химик Одлинг расположил 48 элементов в группах (табл. 1) по сходству химических свойств (горизонтальные строки).
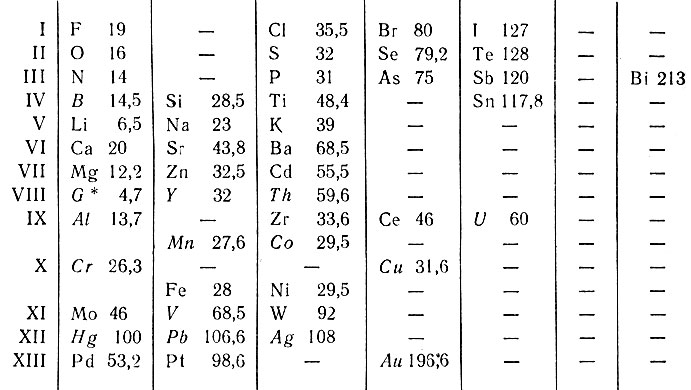
Таблица 1. Естественная группировка элементов Одлинга (1857 г.)
* (G или Gl - Прежний символ элемента бериллия (Be) от названия глюциний (Glucinium).)
В таблице Одлинга отсутствуют 11 известных в то время элементов и среди них такие, как углерод и водород. В первых пяти группах Одлинг пользуется атомными весами, а в остальных - эквивалентными (кроме золота). Слева направо все элементы расположены в порядке возрастания атомных весов, но в вертикальных колонках значения атомных весов изменяются бессистемно. Элементы: Mn, Со и Fe, Ni помещены вне групп системы; число групп не имеет обоснования. Только первые семь групп включают элементы, являющиеся химическими аналогами (кроме В в IV группе). Элементы, символы которых набраны курсивом (курсив наш - В. С.), химически не сходны между собой и большинством элементов данной группы. Нельзя обосновать заполнение одним элементом седьмой вертикальной колонки и отсутствие элементов в шестой колонке.
Из критического рассмотрения таблицы Одлинга следует, что она не является естественной группировкой элементов ввиду непоследовательности ее построения и произвольных допущении в размещении элементов.
Известен и еще ряд попыток раскрыть взаимосвязь между свойствами и атомными весами элементов. Все они оказались безуспешными, хотя и признавалось, что обнаруженные зависимости между атомными (или эквивалентными) весами элементов и их химическими свойствами не могут быть случайными. Эти исследования лучше всего были охарактеризованы Штреккером в 1859 г.:
"Трудно предположить, что все вышеприведенные зависимости между атомными весами (или эквивалентными) в химических свойствах сходных элементов - просто случайны.
Нахождение намечающихся в этих числах закономерностей мы, однако, должны предоставить будущему" (подчеркнуто нами - В. С.).
Неудачу попыток систематизации элементов можно объяснить неточными значениями их атомных весов и ограниченностью известных небольших группировок элементов со сходными химическими свойствами. О классификациях подобного типа Д. И. Менделеев писал:
"Отсутствие твердого руководящего начала при этом становится очевидным, сходство не предугадывается, а подыскивается".
Огромные затруднения в систематизации элементов создавало также отсутствие у ученых того времени единства взглядов и согласованных определений основных понятий в химии. Путаница в представлениях и терминологии была так велика, что для каждой научной статьи по химии нужен был "свои ключ". В то же время состояние и развитие науки настоятельно требовало решения этих вопросов.
Поворотным этапом в развитии химии явился первый Международный съезд химиков, состоявшийся в немецком городе Карлсруэ в сентябре 1860 г. Ясное представление о задачах этого съезда дает выдержка из текста официального приглашения, разосланного 10 июля 1860 г. организационным комитетом:
"Химия дошла до такой точки, что нижеподписавшимся кажется целесообразным при помощи встречи возможно большого числа химиков, научно работающих и преподающих, положить начало соглашению по отдельным важным вопросам... и, в частности, облегчить согласование относительно следующих главных вопросов: более точного определения понятий, выражаемых словами - "атом", "молекула", "эквивалент", "атомность" "основность" исследования действительного эквивалента тел и их формул; начала более однотипного обозначения и рациональной номенклатуры".
Станислао Канниццаро (1826-1910)
Съезд в Карлсруэ привлек большое число участников из разных стран - 127 человек. Русскую химическую науку представляли: А. П. Бородин, Н. Н. Зинин, Т. Лесинский, Д. И Менделеев, Я. Ф. Натансон, В. Савич и Л. Н. Шишков.
Наиболее выдающимся событием на съезде было выступление итальянского химика Канниццаро, убедительно показавшего необходимость введения в химию представлений Авогадро, подтвержденных и развитых Жераром, о молекулярном строении вещества. Еще до съезда Канниццаро опубликовал брошюру "Конспект курса химической философии" (1858 г.) в которой придал гипотезе Авогадро (1811 г.) о равном числе' молекул - наимельчайших самостоятельно существующих частиц вещества - в равных объемах газа значение закона, показал его применимость для разрешения ряда основных вопросов химии и предложил способы точного определения молекулярных и атомных весов.
Взгляды Канниццаро получили признание и одобрение как на съезде, так и по мере ознакомления широких кругов химиков с его работами. Впоследствии Д. И. Менделеев говорил:
"... решающим моментом в развитии моей мысли о периодическом законе я считаю 1860 год - съезд химиков в Карлсруэ, в котором я участвовал, и на этом съезде - идеи, высказанные итальянским химиком Канниццаро".
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'