
От международного съезда до открытия Д. И. Менделеева
Принятые съездом химиков единые определения основных понятий химии, установление разграничений между молекулами и атомами способствовали распространению атомно-молекулярных воззрений, что в дальнейшем привело к всеобщему признанию и утверждению атомно-молекулярного учения. Постепенно становятся более ясными различия между простыми и сложными веществами. Начинает использоваться понятие об атомности - свойстве атома данного элемента присоединять или замещать определенное число атомов водорода, введенное в химию английским химиком Э. Франкландом еще в 1852 г.* Исходя из валентности элементов, можно было уточнять данные о составе веществ и по их молекулярным весам (определяемым по методу Канниццаро) находить точные значения атомных весов элементов.
* (Равнозначный термин валентность был предложен в 1868 г. Вихельгаузом.)
Все это, естественно, расширяло возможности классификации элементов и приводило к появлению новых гипотез и таблиц, более или менее спорных или уже приближающихся по форме к первоначальным вариантам периодической системы Д. И. Менделеева. Рассмотрим некоторые из предложенных теорий и таблиц.
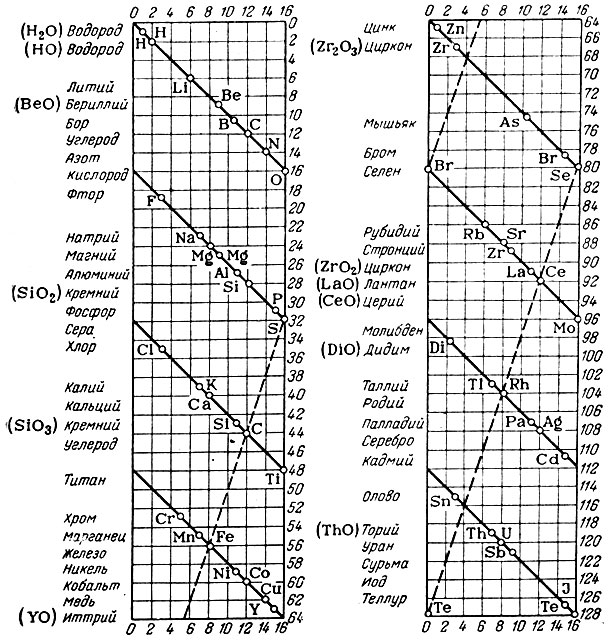
Таблица 2. Таблица химических элементов де Шанкуртуа

Юлиус Лотар Мейер (1830-1895)
Система элементов, предложенная де Шанкуртуа (1863 г.), основывалась на выдвинутой им гипотезе, что каждому целочисленному значению атомного веса отвечает особый элемент; каждые 16 элементов составляют группу, при этом атомные веса замыкающих элементов групп кратны 16 и соответственно равны 16, 32, 48, 64, 80, 96, 112 и 128. Система элементов де Шанкуртуа изображена на цилиндре (табл. 2), развернутом в плоскость. Параллельно основанию цилиндра проведены линии, отвечающие значениям атомных весов от 0 до 128, а параллельно оси цилиндра идут образующие линии, обозначенные от 0 до 16. На поверхности цилиндра под углом в 45° проведена спиральная линия, точки на которой отвечают определенным элементам. Сходные по свойствам элементы, например, кислород, сера, селен и теллур, располагаются на одной образующей линии или рядом с ней. Однако находящиеся на этой же линии титан и медь к данной группе никакого отношения не имеют. Вместе с углеродом и кремнием в одну группу неудачно помещены кобальт, церий и серебро, а в одну группу со щелочными металлами - марганец и т. д.
Отмечая явный произвол расположения элементов в системе де Шанкуртуа, Л. А. Чугаев все же нашел, что:
"... де Шанкуртуа сделал попытку построить систему, объединяющую все" элементы и устанавливающую закономерную связь между их атомными весами... в этой системе заключается уже зародыш периодического закона".
В таблице элементов, опубликованной немецким химиком Л. Мейером в книге "Новейшие теории в химии и их значение для химической статики" (1864 г.), были использованы канниццаровские атомные веса с указанием разности атомных весов двух соседних элементов и впервые отмечена их атомность. В вертикальных столбцах Мейер расположил элементы, которые он считал аналогами. Ниже приведены данные Л. Мейера:

Разность в атомных весах двух соседних по вертикали элементов-аналогов более или менее постоянна (исключение составляет пара Tl-Cs). Марганец и железо занимают одно место (?). Никель и кобальт, платину и осмий следовало бы поменять местами, но оснований к этому у Л. Мейера в то время не было. Места тантала и ванадия указаны неправильно: они должны были бы находиться в столбце пятиатомных элементов, но такого столбца нет. В таблице отсутствуют элементы: водород, бор, алюминии и др. Периодичность изменения свойств элементов из таблицы Л. Мейера не вытекает.
Спустя четыре года (1868 г.) Л. Мейер опубликовал полудлинную форму таблицы (табл. 3), в которой впервые были указаны периоды. Эта таблица должна состоять из 18 групп но в данной таблице Мейера пропущены группы 3-я, 13-я и 18-я, а лишней оказалась 16-я группа, так как в ней нет ни одного элемента. В таблицу не включены известные в то время элементы - H, В, In, Y, Nb, Th и U. Отсутствует первый период, в котором по общему смыслу всех данных должен быть только один элемент - водород, но, по-видимому, Мейер сомневался в возможности комплектования периода одним элементом. Неправильно размещены 12 элементов, заключенные нами в пунктирные прямоугольники. Из приведенных замечаний видно, что таблица Л. Мейера не охватывала всех известных элементов и была еще далека от правильного завершения их классификации.
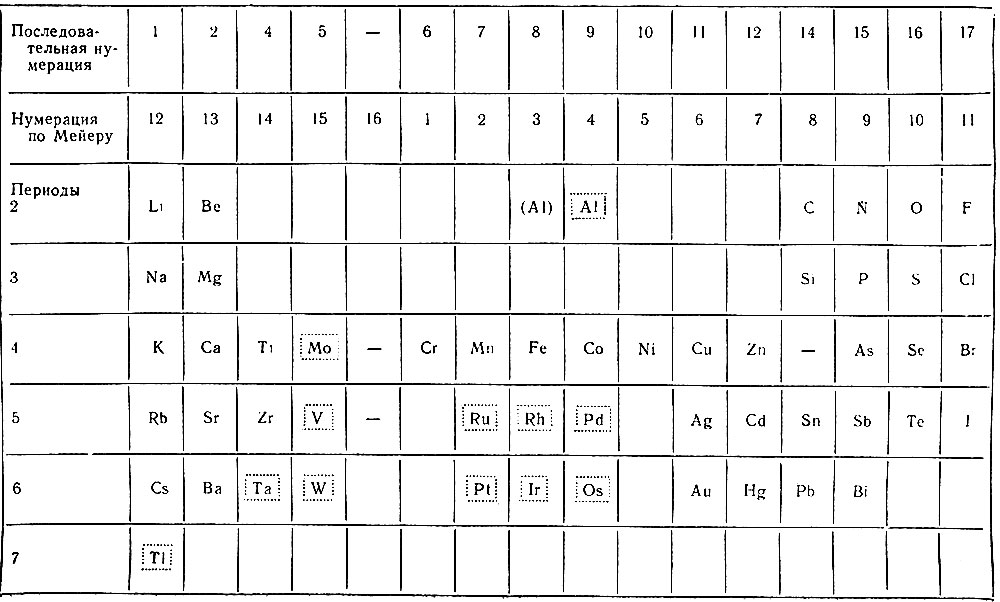
Таблица 3. Полудлинная форма таблицы химических элементов Л. Мейера
Несколько новых вариантов таблицы элементов, в которых элементы располагались в порядке возрастания их атомных весов, были опубликованы Одлингом, начиная с 1864 г. В таблице, относящейся к 1868 г. (табл. 4), изолированное место занимает водород; в горизонтальных рядах сгруппированы химические аналоги, пунктирными линиями отграничена центральная часть таблицы. В таблице отсутствуют 9 элементов: Fe, Ni, Co, Cu, Ru, Rh, Ir, Os, Та; элементы Li и Na отделены от других щелочных металлов (К, Rb, Cs); неправильно расположен ванадий (V). В таблице имеется ряд интересных сближений элементов по их природе, например, Тl помещен в одном ряду с В и Al, a Pb - вместе с С и Si и др. К сожалению, автор не дал к таблице какого-либо пояснительного текста.
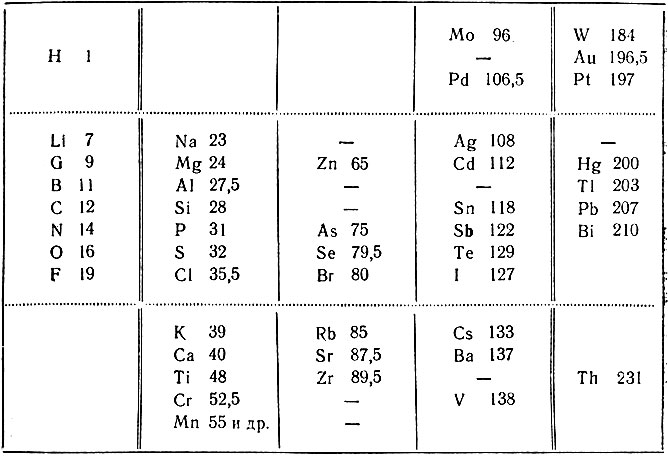
Таблица 4. Таблица химических элементов Одлинга (1868 г.)
Английскому ученому Ньюлендсу принадлежит формулировка закона "октав", согласно которому свойства элементов повторяются приблизительно через каждые семь элементов на восьмой, подобно повторению звуков в музыкальной октаве. Перенумеровав элементы в порядке возрастания значений атомных весов, он ввел в таблицу последовательные номера элементов от водорода до тория (табл. 5).
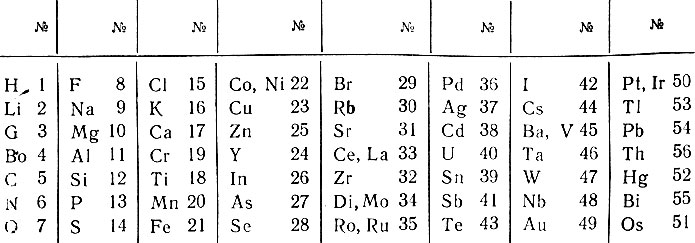
Таблица 5. Октавы химических элементов Ньюлендса (1885 г.)
Ввиду того что расположить 62 элемента по одному на 56 местах невозможно, Ньюлендс был вынужден в шести случаях ставить на одно место по два элемента, что являлось существенным недостатком его таблицы. Вторым недостатком таблицы было отсутствие свободных мест между первым и пятьдесят шестым элементами, что не допускало предположения о возможности существования в природе каких-либо элементов, кроме уже открытых. Нарушение последовательности номеров элементов (19-18, 25-24, 33-32, 40-39, 43-42 и в последней вертикальной колонке) также не получило объяснений. Закон октав не был принят современниками, хотя в нем правильно указывались периодические закономерности в изменении свойств химических элементов с возрастанием их атомного веса. Известно, что когда Ньюлендс выступал с докладом в Лондонском химическом обществе, профессор Фостер иронически спросил его:
"Не пробовал ли он расположить в таблице элементы в алфавитном порядке и не заметил ли при таком расположении каких-либо новых закономерностей?"
К концу 60-х годов прошлого столетия насчитывалось около 50-ти попыток классификации элементов, но периодическая система элементов все еще не была создана. К этому времени кроме ранее упомянутых 56 элементов были открыты методом спектрального анализа* 4 элемента:
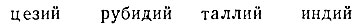
и получили подтверждение еще три элемента:
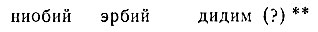
* (Открытие спектрального анализа явилось значительным событием в науке. Изучение состава солнца и звезд показало, что химические элементы земли являются элементами космоса; тем самым подтверждалось единство материального мира.)
** (Впоследствии из дидима были выделены два элемента: празеодим и неодим.)
Итак, всего к 1869 г. стало известно 63 элемента, атомные веса которых, благодаря успехам физической и аналитической химии, можно было определить с достаточной точностью. Предоставлялась возможность группировать элементы по сходным свойствам, пользуясь большим запасом практических сведений которым уже располагала химия, а также и на основе открытых закономерностей в изменении свойств элементов в зависимости от возрастания значений атомных весов. Казалось а впоследствии и утверждалось в некоторых высказываниях что для установления правильной классификации требовалось сделать совсем немного. Тем не менее для построения системы элементов, основанной на общей принципиальной закономерности и охватывающей все элементы, требовалось нечто значительно большее, чем нахождение более или менее удачного варианта расположения элементов в таблицах самой разнообразной формы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'