
Периодический закон химических элементов
Продолжая упорно работать над разрешением спорных вопросов, устранением противоречий и несоответствий в расположении элементов, Д. И. Менделеев составляет еще четыре наброска таблицы, являющихся как бы новыми эскизами "опыта системы", приближающимися к естественной системе элементов.
Основные свои мысли Д. И. Менделеев изложил в статьях "Об атомном объеме простых тел" и "О количестве кислорода в соляных окислах и об атомности элементов" и высказал их на втором съезде русских естествоиспытателей в августе 1869 г. Во первых, ему удалось выявить двойные сходственные отношения между элементами, первоначально расположенными в различных группах. Например, подгруппа элементов Be, Mg, Ca, Sr, Ba по свойствам сходна с подгруппой элементов Zn, Cd, Hg, и, следовательно, эти две подгруппы должны составлять одну группу, характеризующуюся максимальной валентностью элементов, равной двум. Принципиально новым здесь было комплектование одной группы элементов из двух подгрупп (развитие мысли Гинрихса). Во-вторых, Д. И. Менделеев принял, что удельные и атомные объемы простых веществ, образованных из элементов, стоящих в одной группе, изменяются закономерно с изменением атомных весов. Это позволило ему исправить атомные веса для 11 элементов и изменить местоположение в системе 20 (!) элементов.
Наконец, Менделеев отмечает, что все свойства того или иного элемента закономерно связаны со свойствами четырех соседних элементов, а именно: двух аналогов по валентности, стоящих в одной группе, и двух соседей в горизонтальном ряду. На основании этого он делает важное обобщение:
"Атомные веса, как и аналогии, определяются не по свойствам элементов, а по свойствам и составу соединений".
Такими соединениями, состав которых наглядно выражает закономерное изменение важнейшего свойства элементов - валентности, Менделеев считает высшие окислы элементов:
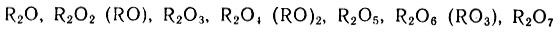
Из формул окислов следует, что валентность элементов по кислороду изменяется от 1 до 7.
Сопоставляя высшие окислы элементов и их водородные соединения Менделеев приходит к заключению, что чем больше атомов кислорода присоединяет атом данного элемента, тем с меньшим числом атомов водорода он соединяется:
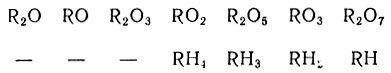
Повторяющиеся изменения типа высшего кислородного и водородного соединения по рядам элементов в таблице служат убедительным доказательством периодического изменения свойств элементов.
В 1871 г. Д. И. Менделеев в статье "Периодическая законность химических элементов" опубликовал новый вариант периодической системы (табл. 6), в которой нашли отражение найденные им закономерности.

Таблица 6. Периодическая система химических элементов Д. И. Менделеева (1871 г.)
В этом варианте в систему введена восьмая группа элементов, так как все известные элементы не могли быть размещены в семи группах.
В той же статье Д. И. Менделеев приводит расширенную формулировку периодического закона:
"Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса".
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'