
Периодический закон Д. И. Менделеева И "Основы химии"
""Основы химии" и периодический закон неотделимы один от другого, и правильное понимание периодического закона без "Основ химии" является совершенно невозможным".*
* (А. А. Байков, Труды Юбилейного Менделеевского съезда, т. I, Изд. АН СССР, 1936, стр. 28.)
Открытие Д. И. Менделеевым периодического закона совпало по времени и неразрывно связано с его работой над книгой "Основы химии", изданной (в двух томах) в 1869-1871 г. При жизни Дмитрия Ивановича она издавалась восемь раз с его исправлениями, замечаниями и большим количеством дополнений (8-е издание вышло в 1906 г.). В течение многих лет книга "Основы химии" служила настольным руководством и пособием для русских химиков; она была переведена на ряд иностранных языков, причем троекратно издавалась в переводе на английский (1891, 1897 и 1905 г.). За годы Советский власти книга Д. И. Менделеева издавалась с соответствующими дополнениями еще пять раз (5-е советское издание в 1947 г.), она интересна и в настоящее время.
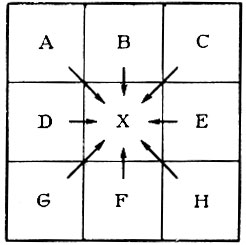
Рис. 1. Свойство любого элемента X находится в закономерной связи со свойствами соседних элементов по горизонтали (D, Е), вертикали (В, F) и диагонали (А, Н и CG)
Во втором томе первого издания "Основ химии" изложены основные идеи периодичности и помещена естественная система элементов. Принципиально она мало отличается от предыдущего варианта; в ней также введены координаты "ряд" - "группа", а места пересечений линий ряда и группы отвечают определенному элементу. Под символами элементов помещены формулы наиболее типичных соединений, что загромождало таблицу (в последующих вариантах формулы были исключены).
Последним элементом в системе стал уран, для которого Д. И. Менделеев, основываясь на периодическом законе, изменил атомный вес со 116 на 240. В отношении урана он писал:
"Интерес дальнейшего изучения возрастает при изменении атомного веса еще и потому, что его атом оказывается тяжелейшим из всех известных элементов ...Убежденный в том, что исследование урана, начиная с его природных источников, поведет еще ко многим новым открытиям, я смело рекомендую тем, кто ищет предметов для новых исследований, особо тщательно заниматься урановыми соединениями"...
За ураном Д. И. Менделеев поставил пять черточек, отвечающих пяти еще неизвестным элементам с атомными весами 245-250, что было указанием на возможность открытия трансурановых элементов, подтвердившимся впоследствии (после 1940 г. искусственно получено 12 элементов, стоящих за ураном).
Исходя из того, что свойства любого элемента X находятся в закономерной связи со свойствами соседних элементов (рис. 1) по горизонтали (D, Е), вертикали (В, F) и диагоналям (А, Н и С, G), Д. И. Менделеев использует эту "звездность", или атоманалогию*, для предсказания 11 еще неизвестных элементов: экацезия, экабария, экабора, экаалюминия, экалантана, экасилиция, экатантала, экателлура, экамарганца, двимарганца и экаиода**. В отношении трех из них - экабора, экаалюминия и экасилиция (условные символы которых Eb, Ea, Es) - у Менделеева была особенно твердая уверенность в возможности их открытия.
* (Свойства элемента должны быть среднеарифметическими из свойств окружающих его элементов.)
** (Приставка эка означает - еще один, а два - второй.)
В период между выходом в свет второго (1872 г.) и третьего (1877 г.) изданий книги "Основы химии" предсказание Д. И. Менделеева подтвердилось. Французский химик Лекок де Буабодран в 1875 г. открыл новый элемент - галлий, свойства которого, установленные экспериментально, поразительно совпали со свойствами предсказанного экаалюминия (табл. 7).
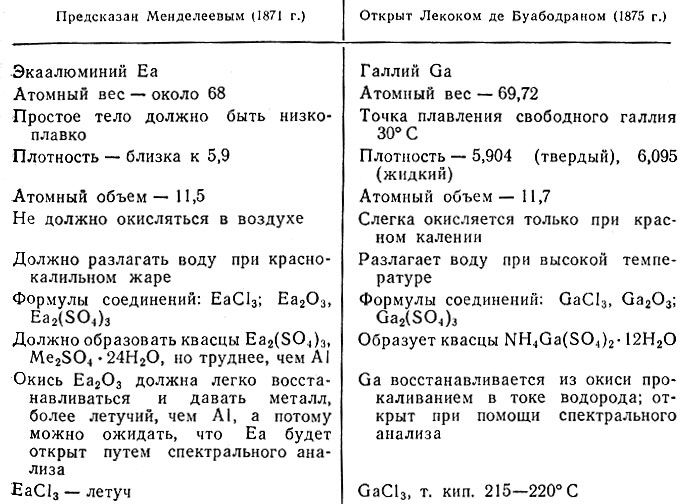
Таблица 7. Свойства галлия

Поль Эмиль Лекок де Буабодран (1838-1912)
Первоначально де Буабодран определил плотность галлия - 4,7. Менделеев в письме к нему указал, что это значение ошибочно и является результатом работы с нечистым образцом, а в действительности плотность галлия должна быть равной 5,9-6,0. При вторичном определении плотности очищенного от примесей галлия была получена величина 5,904.
Работы Менделеева не были известны де Буабодрану и его открытие не связано с периодическим законом. Тем не менее он позднее писал:
"Я думаю нет необходимости настаивать на огромном значении подтверждения теоретических выводов г. Менделеева относительно плотности нового элемента".
Гениальность предвидения Д. И. Менделеева восторгает К. А. Тимирязева:
"Менделеев объявляет всему миру, что где-то во вселенной... должен найтись элемент, которого не видел еще человеческий глаз, и этот элемент находится, и тот, кто его находит при помощи своих чувств, видит его на первый раз хуже, чем видел его умственным взором Менделеев".*
* (К. А. Тимирязев, "Научные задачи современного естествознания", Изд. 3-е, Москва, 1908, стр. 14.)
Открытие галлия дало Д. И. Менделееву уверенность в истинности периодического закона и в третьем издании "Основ химии" он вводит новую главу - "Сходство элементов и их система (изоморфизм), форма соединений, периодический закон, удельные объемы". В другой главе приведены все известные данные о свойствах галлия. Этот элемент впервые был введен в вариант системы, названной "Периодическая система химических элементов, основанная на их атомном весе и химическом сходстве".

Ларс Фредерик Нильсон (1840-1899)
В конце 1879 г. шведский ученый Нильсон открыл предсказанный Д. И. Менделеевым экабор и назвал новый элемент скандием (табл. 8). Нильсон писал о совпадении предсказанных и экспериментально найденных свойств нового элемента:
"... не остается никакого сомнения, что в скандии открыт экабор...; так подтверждаются самым наглядным образом мысли русского химика, позволившие не только предвидеть существование названного простого тела, но и наперед дать его важнейшие свойства".

Таблица 8. Свойства скандия
В четвертом издании "Основ химии" (1882 г.) новый элемент включен в систему элементов и приведены данные о его свойствах. Перед значением атомного веса 72 Менделеев, ожидая открытия этого элемента, поставил знаки вопроса (табл. 9).
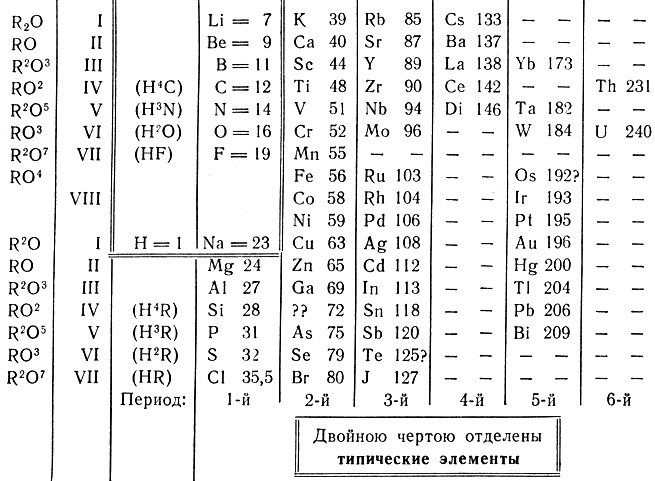
Таблица 9. Периодическая система химических элементов, основанная на их атомном весе, выражающая их сходство и соответствующая их способности к соединению с кислородом, водородом и другими элементами. Расположение элементов по периодам
Вверху таблицы элементы четных, внизу - нечетных рядов.
("Основы химии", изд. 4-е, ч. I, СПб, 1881, стр. XVI.)
Решающую победу периодический закон одержал в 1886 г., когда немецкий химик Винклер открыл новый элемент - германий. Свойства, установленные для этого элемента опытным путем, полностью совпали со свойствами, указанными Менделеевым для экасилиция (табл. 10).

Таблица 10. Свойства германия
По поводу открытия германия Винклер отмечал:
"... исследование его свойств составляет необыкновенно привлекательную задачу еще и в том отношении, что задача эта является как бы пробным камнем человеческой проницательности. Вряд ли может существовать более ясное доказательство справедливости учения о периодичности элементов, чем открытие до сих пор гипотетического "экасилиция"; оно составляет, конечно, более чем простое подтверждение смелой теории, оно знаменует собой выдающееся расширение химического поля зрения, гигантский шаг в области познания".
Отвечая Винклеру, в 1886 г. Менделеев писал:
"В наше время (действий) едва ли кого-нибудь будут интересовать одни только утверждения, потому мы должны рассматривать как делающие эпоху утверждения, получившие свое реальное осуществление". (Подчеркнуто нами - В. С.)

Клеменс Винклер (1833-1904)
В пятом издании книги "Основы химии" (1889 г.) германий был включен в систему элементов на заранее предназначенное ему место и описаны его свойства.
После открытия германия периодический закон Д. И. Менделеева получил всемирное признание, а периодическая система стала необходимым пособием при изучении курса химии. Однако дальнейшее развитие химии, открытие новых элементов и изучение их свойств вызывали необходимость в дополнениях и изменениях периодической системы, определении в ней места новых элементов и разрешения возникавших спорных вопросов, что не проходило без сомнений и затруднений. Примером этому служит открытие инертных газов.
В 1894 г. английские ученые Рэлей и Рамзай обнаружили, что при нормальных условиях литр азота, выделенного из воздуха (после удаления из него паров воды, двуокиси углерода и кислорода), весит 1,2572 г, а литр азота, полученного разложением азотсодержащих веществ, весит меньше - 1,2505 г. Эта разница не могла быть объяснена ошибкой опыта, в связи с чем было сделано предположение, что в азоте, полученном из воздуха, содержится неизвестный более тяжелый газ. Пропуская азот через накаленный магний (при этом получается нитрид магния), ученые химически связали азот и изолировали неизвестный газ. Было установлено, что молекула этого газа одноатомна, атомный вес равен 40 и атомы газа не соединяются между собой и с атомами других элементов. Газ оказался химически недеятельным, а потому был назван аргоном ("ленивый") и обозначен символом А (впоследствии Аr).

Уильям Рамзай (1852-1916)
В первое время Д. И. Менделеев не считал аргон элементом* и принимал его за полимеризованный азот N3 с атомным весом в 1,5 раза большим, чем у N2, подобно озону O3, являющемуся аллотропическим видоизменением кислорода О2, но в дополнении к V главе шестого издания (1896 г.) "Основ химии" он все же дал описание нового элемента - аргона.
* (Клетка, отвечающая атомному весу 40 в периодической системе, была занята кальцием.)
Дальнейшие исследования Рамзая подтвердили элементарную природу аргона, и на основании периодической системы он высказал мысль о существовании группы таких элементов:
"По образцу нашего учителя Менделеева, я описал, поскольку возможно было, ожидаемые свойства и предполагаемые отношения". Пользуясь менделеевским методом, Ю. Томсен предсказывает атомные веса предполагаемых элементов.
Вскоре Рамзай и Траверс открыли еще четыре инертных газа: гелий, неон, криптон и ксенон. Эррера предложил ввести для этих элементов нулевую группу в системе, другие же считали возможным включение их в VIII группу (как принято это и в настоящее время).
Открытие инертных газов явилось неожиданным событием (если не считать предвидения Н. А. Морозова, см. стр. 51) и их место в периодической системе Менделеевым не было предусмотрено. Тем не менее он пришел к следующему выводу:
"...Я более, чем прежде, стал склоняться к тому, что аргон и его аналоги суть элементарные вещества с особой совокупностью свойств, стоящие отнюдь не в VIII группе (как думают некоторые), а образующие особую (нулевую) группу".
В седьмом издании "Основ химии" инертные газы в периодической системе помещены в нулевую группу. Эта группа в одном варианте (с вертикальными периодами) поставлена после группы галогенов, а в другом (с горизонтальными периодами) - перед щелочными металлами (табл. 11). В систему включен также радий, открытый М. Кюри-Склодовской и П. Кюри в 1898 г. Всего в системе 71 элемент. Так как аргон стоит в системе до калия, атомный вес которого 39,15, Менделеев принимает атомный вес для аргона равным 38, хотя опытные данные приводили к значению 39,9.
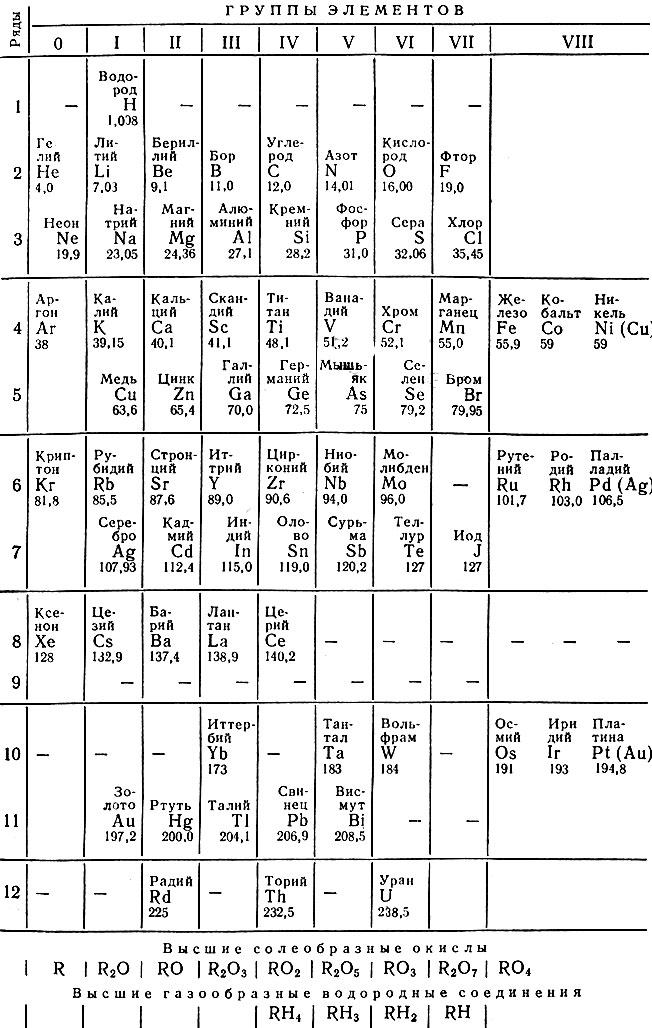
Таблица 11. Периодическая система элементов по группам и рядам

Мария Склодовская-Кюри (1867-1934)
Этот вариант системы без изменений был воспроизведен и в восьмом, последнем издании "Основ химии" (1906 г.), вышедшем при жизни Д. И. Менделеева, в которое он включил ряд примечаний: "Об аргоновых элементах", "Как найден был периодический закон", "О первичной материи", "Об атомных весах никеля и кобальта, теллура и иода и о редкоземельных элементах", "О формах изображения периодического закона", "Законы природы не терпят исключений", "Периодичность принадлежит элементам, а не соединениям". Все эти вопросы имели немаловажное значение для проблемы периодического закона. Объективная оценка истории открытия периодического закона дана самим Менделеевым:
"Таким образом, периодическая законность прямо вытекала из запаса сближений и проверенных сведений, существовавших к концу 60-х годов, она есть свод их в одно более или менее систематическое, цельное выражение..."

Пьер Кюри (1859-1906)
Важнейшими событиями в развитии и утверждении периодического закона Д. И. Менделеев считал открытие галлия, скандия, германия и инертных газов:
"Писавши в 1871 г. статью о приложении периодического закона к определению свойств еще не открытых элементов, я не думал, что доживу до оправдания этого следствия периодического закона, но действительность ответила иначе. Описаны были мною три элемента: экабор, экаалюминий и экасилиций, и не прошло 20 лет, как я имел уже величайшую радость видеть все три открытыми и получившими имена от тех стран, где найдены редкие минералы, их содержащие, и где сделано их открытие: галлия, скандия и германия. Л. де Буабодрана, Вильсона и Винклера, их открывших, я, со своей стороны, считаю истинными укрепителями периодического закона. Без них он не был бы признан в такой мере, как это случилось ныне. В такой же мере я считаю Рамзая утвердителем справедливости периодического закона, так как он открыл Не, Ne, Ar, Кr и Хе, определил их атомные веса, и эти числа вполне подходят к требованиям периодической системы элементов". ("Основы химии", изд. 13, т. II, 389-390).
К "укрепителям" периодического закона Менделеев относит также чешского ученого Браунера, экспериментальные работы которого были связаны с периодической системой, с разработкой методов определения атомных весов и изучения свойств редкоземельных элементов. Д. И. Менделеев упоминает и о работах Л. В. Писаржевского в области изучения строения и свойств перекисей и надкислот, имевших немаловажное значение для периодического закона.
"Основы химии" Д. И. Менделеева - это не только учебник, излагающий в логической и исторической последовательности процесс развития химии как науки, но и замечательный основополагающий труд, вносящий в эту науку принципиально новое содержание, систему и средство познания всего накопленного" ею материала.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'