
Периодичность свойств простых и сложных веществ
Исследования ученых XIX столетия, считавших атом конечной, неделимой и "бесструктурной" частицей элементарного вещества, естественно, не могли быть направлены "в глубь" атома; основное внимание уделялось изучению многообразных свойств элементарных и сложных веществ, в зависимости от расположения элементов в периодической системе. Помимо основных химических свойств, например, валентности, изменения металлического и неметаллического характера элементов, изменения состава и химического характера окислов и гидроокисей, изучались многочисленные физические свойства веществ: температуры кипения и плавления, плотности и атомные объемы, удельные объемы и коэффициенты сжатия, спектры элементов, магнитные и электрические свойства, теплоты образования и теплоемкости и т. д.*.
* (В монографии проф. В. Я. Курбатова (Закон Д. И. Менделеева, НХТИ, 1925) дан обзор исследований, связанных с применением периодического закона к изучению различных свойств элементов и их соединений.)
Табл. 16 дает представление о приложимости периодического закона к изучению веществ и их свойств.
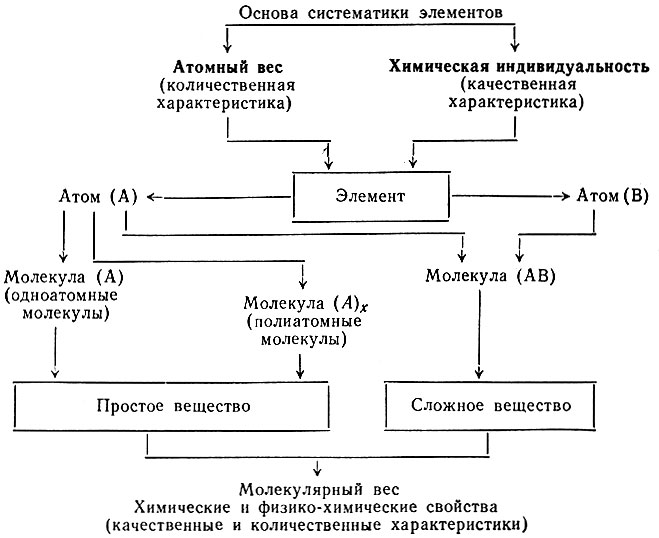
Таблица 16. Периодический закон и его приложение Д. И. Менделеев (1869 г.). Периодический закон химических элементов
Сопоставление физических свойств элементов приводит к заключению, что их изменения также носят периодический характер, но эта периодичность не всегда совпадает с периодичностью изменения химических свойств. Сравним некоторые свойства элементов-аналогов 3-го и 4-го периодов:
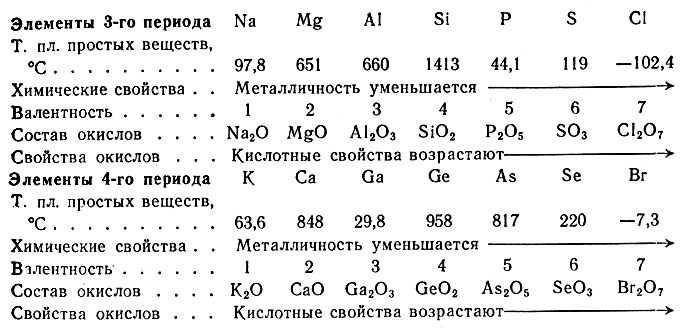
Из этих данных видно, что у элементов 3-го и 4-го периодов закономерно изменяются валентность, химические свойства, состав и свойства окислов. В изменениях температур плавления простых веществ по периодам закономерности не наблюдается. Если же сравнивать температуру плавления простых веществ-аналогов по вертикали, то в группах Na, Al и Si она снижается, а в остальных группах аналогов - повышается.
Максимальное значение температуры плавления высших окислов свойственно элементам IV побочной группы, а именно: двуокисям титана, циркония и гафния (ТiO2, ZrO2, НfO2). Эти соединения широко используются в технике для производства изделий из тугоплавкого фарфора.
Сопоставление значений плотности (в г/см3) щелочных металлов, расположенных в I главной группе периодической системы показывает, что плотность натрия имеет повышенное значение (она должна быть меньше, чем у калия):
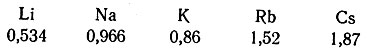
Подобные отступления характерны для первых двух элементов каждой главной группы периодической системы: Д. И. Менделеев называл эти элементы типическими.
Отклонения в изменениях свойств элементов по периодам и группам иногда не получают приемлемого обоснования, а в некоторых случаях объясняются тем, что свойства веществ изучались в несопоставимых условиях.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'