
Варианты периодической системы
Периодическая система химических элементов открыла новые возможности для научного поиска в области химии.
Вместе с тем возник и ряд затруднений в вопросах размещения в таблице новых элементов.
С 1869 по 1907 г. были открыты следующие элементы:
галлий, скандий, германий, гелий, неон, аргон, криптон, ксенон, радий, полоний, радон, актиний, иттербий, неодим, празеодим, самарий, тулий, европий, гольмий, гадолиний, диспрозий, тербий, лютеций.
Общее число известных элементов достигло 85, что значительно расширило периодическую систему. К этому времени форма таблицы, предложенная Д. И. Менделеевым, не полностью удовлетворяла химиков. Так, сведенные в таблицу данные об элементах были недостаточны для определения числа редкоземельных элементов и их мест в системе; нельзя было пои помощи таблицы определить и общее количество элементов, расположенных между самым легким из них - водородом и самым тяжелым - ураном. Аномалии в расположении трех пар элементов, в которых более легкий элемент помещается после более тяжелого (Аr = 39,9 и К = 39,15; Со = 58,94 и Ni = 58,69; Те = 127,6 и I = 126,9) не находили объяснений. Кроме того, возникали и другие вопросы, связанные не только с расположением элементов в таблице, но и их свойствами. Непонятны были причины того, что не всегда соблюдается максимальная валентность элементов, отвечающая номеру группы. Вызывали недоумение отсутствие какой-либо закономерности в изменениях разности атомных весов двух соседних элементов, расположенных как в одном ряду, так и в параллельных группах, а также дробные значения атомных весов для большинства элементов. Большой интерес представлял вопрос, возможно ли существование элемента с атомным весом и свойствами, позволяющими поместить его между водородом и гелием. Некоторые химики, в том числе и Д. И. Менделеев, допускали возможность открытия галогена с атомным весом, равным трем.
Можно указать и еще на ряд вопросов, например, почему у элементов-аналогов большинство свойств среднего элемента не совпадает со среднеарифметическими значениями свойств-крайних элементов (подгруппа Сu-Ag-Аu); почему не сходные по своей природе элементы помещены в одной и той же группе (калий и медь, марганец и хлор) и т. д.
В связи с этим многие ученые, принимая за основу те же закономерности, что и Менделеев, пытались отыскать такой вариант системы, который в большей мере удовлетворял бы требованиям науки.
Периодическая система может быть представлена как в аналитической, так и в графической формах, отражающих взаимозависимость атомных весов элементов и их свойств.
Графические формы весьма разнообразны: это таблицы на плоскости, на поверхности сложных геометрических фигур или их проекций. Они имеют вид концентрических колец, спиралей самых разнообразных конфигураций, пространственных клеток и т. п. Каждый из этих видов может иметь короткую, полудлинную и длиннопериодную форму.
Д. И. Менделеев отрицательно относился к геометрическим построениям периодической системы:
"Геометрически можно выразить сказанное таким образом: всякое изложение представляет линию, а система требует телесной формы, допускающей сближения по всем направлениям".
Спустя 20 лет после открытия закона свое отношение к этому вопросу он резюмировал, говоря, что периодический закон
"...следует выражать не геометрическими линиями, всегда подразумевающими сплошность, а вроде того, как поступают в теории чисел - прерывно. По этим соображениям, я никогда не выражал и выражать не буду периодических отношений никакими геометрическими фигурами".
Действительно, ни одна из предложенных новых геометрических форм построения таблицы элементов не нашла сколь-нибудь широкого применения.
В качестве примера приведем спиральную таблицу химических элементов Баумгауера (1870 г.), в которую нами введена нумерация радиальных линий, число которых ничем не обосновано (табл. 12).
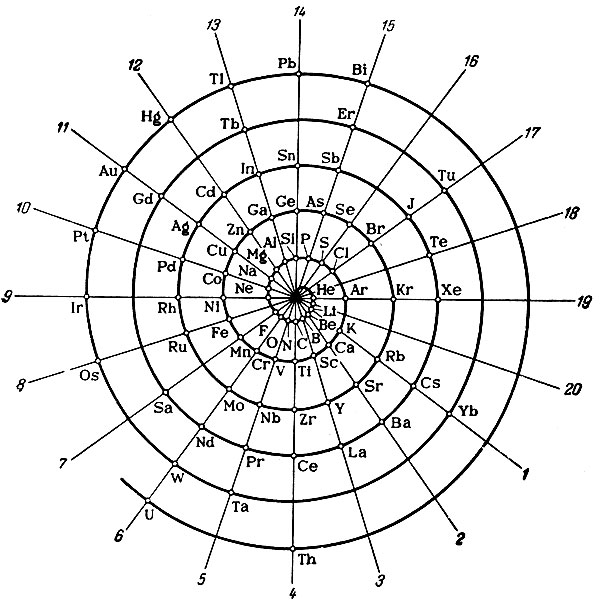
Таблица 12. Периодическая система химических элементов Баумгауера (спиральная форма)
Искусственность построения этой таблицы очевидна: число элементов на радиальных линиях колеблется от одного (линия 18) до шести (линия 6); 29 мест пересечения радиальных линий со спиралью не заняты элементами, некоторые элементы оторваны от своих аналогов (например, N, О, F, Ne), а элементы Gd, Tb, Er, Tm, Yb и другие ничего общего не имеют с элементами, находящимися на данных радиальных линиях; невозможно определить, где начало и конец периодов и число элементов в них; нет доказательств расположения того или иного элемента между двумя другими.
Из клеточных вариантов ограничимся рассмотрением таблиц химических элементов Браунера (короткая форма, табл. 13), Уокера (полудлинная форма, табл. 14) и Вернера (длиннопериодная форма, табл. 15).
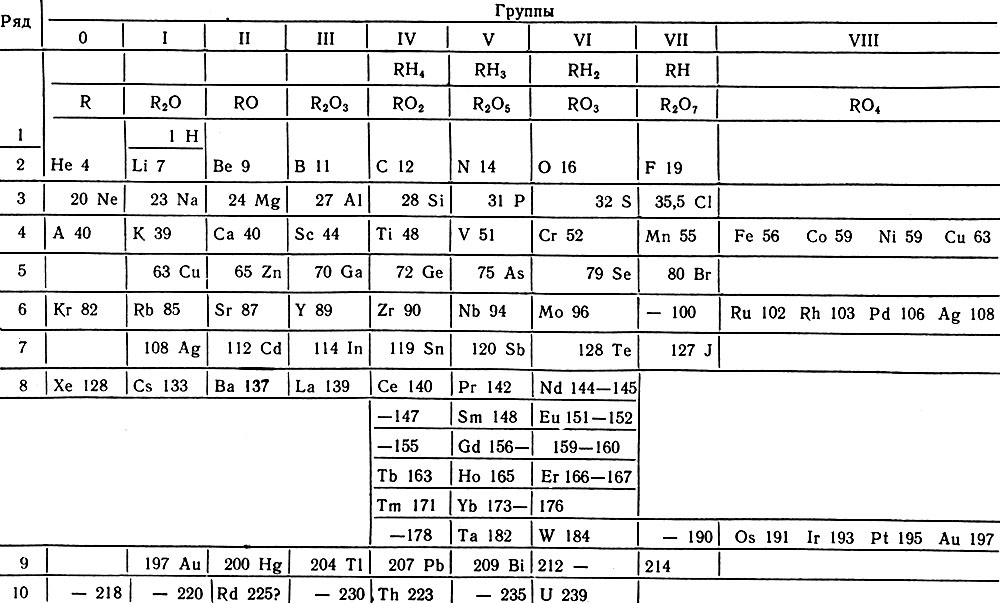
Таблица 13. Таблица химических элементов Браунера
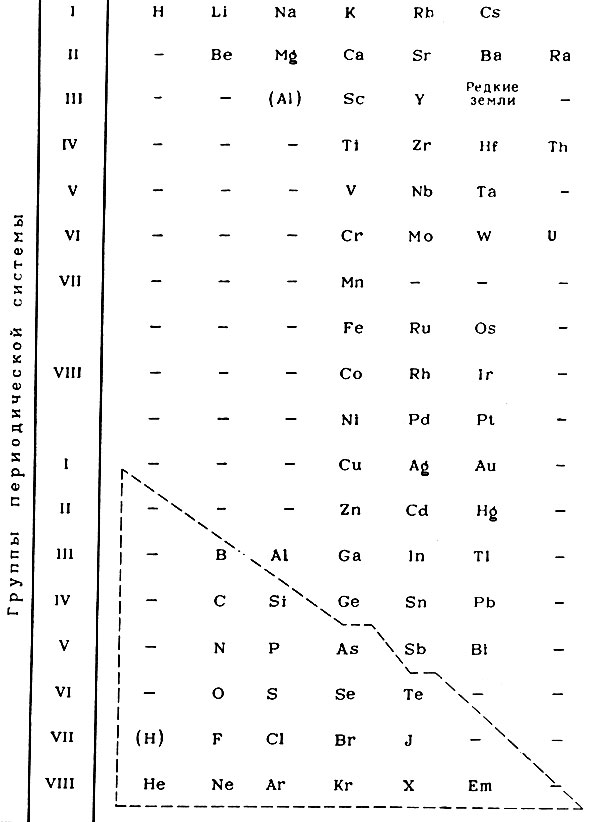
Таблица 14. Периодическая система химических элементов Уокера
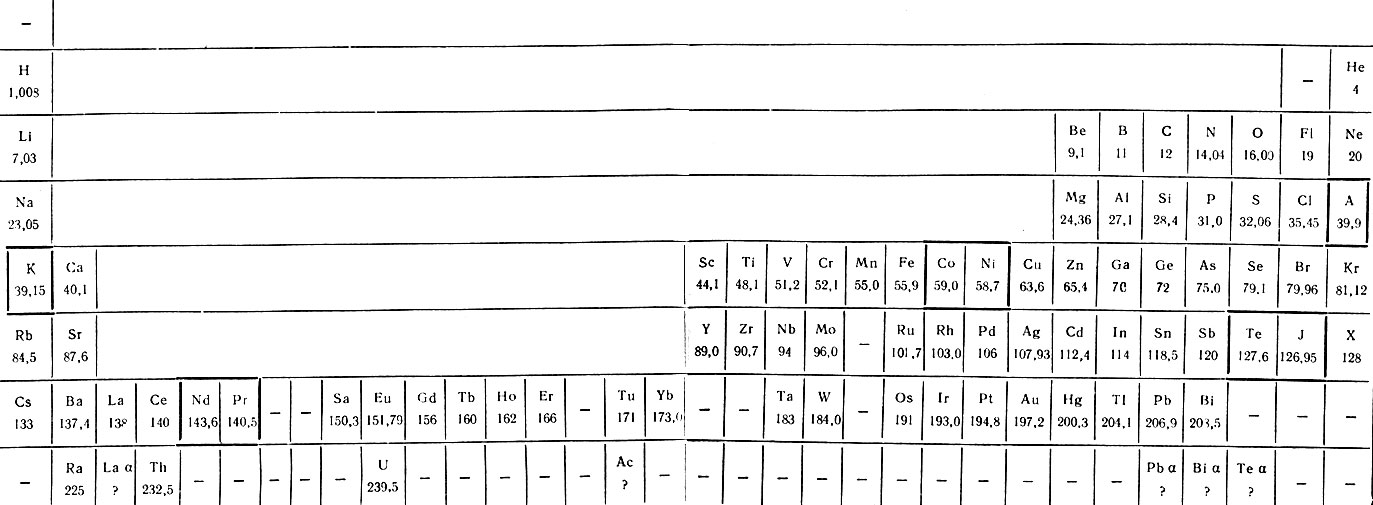
Таблица 15. Таблица химических элементов Вернера (1905 г.)
От периодической системы элементов Д. И. Менделеева таблица Браунера отличается тем, что редкоземельные элементы внесены в нее в виде "интерпериодической" группировки в 8-м ряду, начинающейся Се-140 и заканчивающейся неизвестным элементом с атомным весом 176. Всего в этой группировке 19 мест (позже было выяснено, что пять элементов с атомными весами 147, 152, 155, 160, 167 - лишние). Браунер отнес их к IV группе, что неверно. Элементы Сu, Ag и Аu повторяются в VIII группе.
В таблице химических элементов Уокера редкоземельные элементы расположены в III группе - между Ва и Hf, но число их не указывается. Пунктирной линией отделены неметаллические элементы*. Водород помещен в I и VII группы.
* (X и Em - прежние обозначения ксенона (Хе) и радона (Rn).)
В таблице Вернера семь периодов с числом элементов 2, 8, 8, 18, 18, 33 (VII период незакончен). В клетках, обведенных жирными линиями, расположены элементы с аномалиями в величинах атомных весов (символы Nd и Рr следует поменять местами). В последнем периоде стоящий в 16-й клетке Ас должен быть перенесен на место Laα, а уран помещен за торием.
Стремление создать новые варианты периодической системы внесло полезный вклад в химическую науку, так как позволило шире раскрыть идеи периодичности. Вместе с тем неудачи во многих попытках создать совершенную систему, лишенную недостатков и отвечающую на все вопросы химиков, показывали недостаточность знаний, которыми располагала наука в то время, и говорили о необходимости более глубокого изучения закономерностей изменения масс атомов элементов, чередования их свойств, пропорционального изменения объемов и плотности простых веществ и ряда других явлений.
При этом приобретала немаловажное значение и форма периодической системы, отражающая изменения свойств как самих элементов, так и их соединений. Надо сказать, что Д. И. Менделеев не отдавал предпочтения тому или иному варианту системы. Почти во всех изданиях "Основ химии" горизонтальный и вертикальный, короткий и полудлинный варианты таблицы помещались им на равных основаниях, хотя и отличались длиной периодов. Для решения вопроса о длине всех периодов в системе необходимо было сопоставить разности между атомными весами начальных и конечных элементов различных периодов:

Из данного сопоставления следовало, что 4-й и 5-й периоды должны содержать большее число элементов, чем 2-й и 3-й, но в каждой из этих пар периодов число элементов должно быть одинаково, так как разности атомных весов для каждых этих пар почти тождественны. Периоды 2-й и 3-й были названы малыми, а 4-й и 5-й - большими: они содержат, соответственно, по 8 и 18 элементов.
Интересно, что Д. И. Менделеевым впервые было высказано предположение о возможности 32-членного периода. Сравнивая соответствующие соединения хрома, молибдена, вольфрама и урана, он отмечал:
"Этот факт, равно как и некоторые другие (сходство Pt с Pd, Nb с Та и т. д.), заставляет думать, что кроме малых и больших периодов есть еще и четверные периоды..."
В дальнейшем эта мысль была использована для построения современного варианта длиннопериодной системы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'