
Строение атомов и новая количественная характеристика элементов
Современные представления о строении вещества не имеют ничего общего с теми представлениями, которые сложились в период, предшествовавший открытию периодического закона. Установление природы катодных и каналовых лучей, фото- и термоэлектрических эффектов, открытие электрона и радиоактивного распада говорили о чрезвычайно сложной структуре атомов. Наука доказала, что атомы, являясь в целом электронейтральными частицами, состоят из еще более мелких частиц, обладающих положительным или отрицательным электрическим зарядом, что атомы тяжелых элементов относительно малоустойчивы и самопроизвольно распадаются, превращаясь, в атомы других элементов (например, при распаде радия образуются радон и гелий). Таким образом, установившиеся тысячелетиями представления о материи пережили себя, человеческое познание углублялось внутрь атома. Концепция неделимости атома оказалась несостоятельной.
В XX столетии вместе с бурным развитием техники и промышленности в химию стали внедряться новые физические методы исследования: спектроскопия, рентгеноскопия, масс-спектрография и масс-спектрометрия, электронография, нейтронография, метод меченых атомов и радиоактивных изотопов, парамагнитный и ядерный магнитный резонансы, эффект Мёссбауэра и др. Широко стали использовать новейшую аппаратуру: электронный микроскоп, счетчики и ускорители частиц, атомные реакторы, хроматографы и др. При помощи этих разнообразных методов и аппаратуры удалось проникнуть в недра молекул, атомов и ядер. Изучение строения атома и ядра помогло приподнять завесу над тайной периодического закона и овладеть им.
Штурм атома начался с открытия французским физиком Беккерелем особого свойства веществ, получившего впоследствии название радиоактивности. Им было установлено, что из природной урановой руды (смолки) самопроизвольно испускаются лучи, обладающие высокой проницаемостью: они легко проходят через толщу черной бумаги и вызывают химические изменения в светочувствительном слое фотопластинки. Затем было обнаружено, что как сам уран, так и все его соединения независимо от их состава, обладают тем же свойством, а следовательно, явление радиоактивности есть свойство атомов урана.
Обнаружение радиоактивности урана поставило перед учеными вопрос, является ли это свойство специфическим только для урана или присуще и другим элементам. Вскоре было установлено, что радиоактивностью обладает также и торий. Открытие радиоактивности у тория и урана определило направление научного поиска, в первую очередь в сторону обнаружения радиоактивных элементов, сначала среди тяжелых, а затем и среди других элементов.
Перед учеными встала задача выяснения механизма процесса радиоактивности. После тщательного изучения было установлено, что радиоактивность - это самопроизвольный распад ядер атомов тяжелых элементов, сопровождающийся образованием ядер атомов других элементов и испусканием альфа-, бета- и гамма-лучей (α-, β-, γ-). Самопроизвольный характер радиоактивного распада подтверждался тем, что изменения внешних условий (температуры, давления, электромагнитного поля и др.) не влияли на скорость радиоактивного превращения. Элементы, образующиеся при радиоактивном распаде атомов урана или тория, оказались в свою очередь радиоактивными. Ученые занялись глубоким изучением продуктов распада, выяснением их химической природы и дальнейшим поиском ранее неизвестных элементов.
В конце прошлого и начале этого века супруги Мария и Пьер Кюри, Дебьерн, Резерфорд и Дорн открыли радиоактивные элементы - радий, полоний, актиний и радон (последний первоначально назывался эманацией). С течением времени число известных радиоактивных элементов увеличивалось и к 1912 г. их насчитывалось 39, причем относительная масса этих элементов (атомный вес) была равна или больше 209. Согласно периодическому закону каждому элементу отвечает своя определенная клетка в периодической системе, и перед учеными возникла неразрешимая, как тогда казалось, задача разместить 39 элементов в 10 клетках (от висмута до урана).
При открытии новых радиоактивных элементов ученые изучали их радиоактивные характеристики: тип излучения (α-, β-, γ-), энергию испускаемых частиц и период полураспада, т. е. время, в течение которого распадается половинное количество радиоактивного элемента. Кроме того, устанавливали и химическую природу этих элементов, т. е. совокупность свойств: валентность, тип и состав окисла, хлорида, сульфида, способность к химическим взаимодействиям и другие характеристики. Определяли также и самую главную количественную характеристику элемента - атомный вес. Сопоставляя свойства вновь открытых элементов со свойствами уже известных, определяли аналогов и относили новые элементы к той или иной группе периодической системы.
Например, для радия было установлено, что при радиоактивном распаде он испускает α-частицы с энергией 4,79 Мэв* и γ-частицы с энергией 0,188 Мэв и что его период полураспада равен 1622 годам. По химическим свойствам он является аналогом бария, в своих соединениях проявляет максимальную валентность, равную 2, и должен располагаться во II группе периодической системы. С другой стороны, было известно, что атомный вес радия больше атомного веса бария на 88,6 единицы, т. е. как раз на величину (88-90 единиц), предсказанную Д. И. Менделеевым как разность в атомных весах элементов 6-го и 5-го периодов. На основании этого радий и был размещен непосредственно под барием, т. е. в 6-м периоде II группы периодической системы элементов.
* (Мегаэлектрон-вольт (Мэв) - энергия, которую приобретает электрон при перемещении в электрическом поле в вакууме между двумя точками с разностью потенциалов в 1 миллион вольт.)
Одновременно ученые занимались изучением природы α-, β- и γ-лучей. Было установлено, что α-лучи представляют собой поток частиц - двухзарядных положительных ионов гелия, обозначаемых Не2+, или 4Не2+ (цифра 4, поставленная слева вверху символа, обозначает относительную массу частицы), а β-лучи - это поток электронов, несущих элементарный отрицательный заряд электричества (-1,602·10-19 к) и обладающих незначительной массой - примерно в 1840 раз меньше массы самого легкого атома - водорода. Было установлено также, что γ-лучи - это электромагнитное излучение с очень короткими длинами волн (1 А и меньше) и что γ-лучи могут проявляться как поток частиц, так называемых γ-частиц, несущих энергию определенными порциями, или квантами, не обладающих массой покоя и не имеющих электрического заряда.
Все эти данные помогли в изучении механизма радиоактивного распада. В качестве примера можно рассмотреть механизм α-распада радия и β-распада радия С - элементов II и V групп периодической системы (табл. 17).
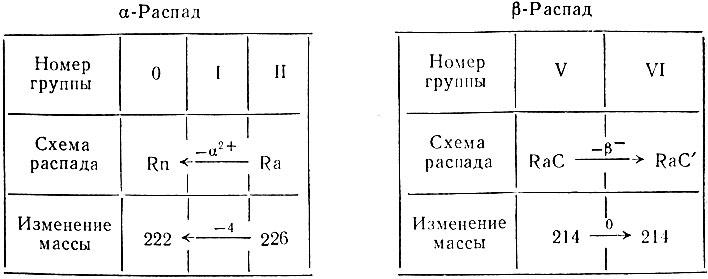
Таблица 17. Радиоактивный распад Ra и RaC
Из таблицы видно, что элемент II группы Ra при α-излучении образует элемент нулевой группы - радон (Rn), обладающий совершенно отличными от радия химическими свойствами и являющийся при обычных условиях газообразным веществом, а это характерно для всех элементов нулевой группы. При β-распаде RaC - элемента V группы - образуется новый элемент RaC с совершенно иными химическими свойствами, соответствующими элементам VI группы, но масса его при этом практически не меняется (излучение электрона изменяет массу только в четвертом знаке после запятой).
Если рассматривать известные схемы распада радиоактивных элементов на фоне периодической системы элементов, можно увидеть, что эти схемы являются как бы "вырезками" из таблицы периодической системы. Изучая схемы и рассматривая последние как часть периодической системы, обобщая все данные о радиоактивном распаде элементов, Содди и Фаянс сформулировали правило, вошедшее в науку под названием правила сдвига или смещения.
При альфа-распаде дочерний* элемент приобретает массу, на 4 единицы меньшую массы материнского элемента, а по отношению к последнему располагается в периодической системе на две клетки левее.
* (Исходный радиоактивный элемент принято называть материнским, а получающийся из него - дочерним.)
При бета-распаде масса атомов практически не меняется, но дочерний элемент по отношению к материнскому занимает место на одну клетку правее.
С помощью периодической системы и правила Содди - Фаянса предстояло выяснить: 1) являются ли радиоактивные элементы независимыми друг от друга или характеризуются общностью происхождения (прерывные ступени в непрерывном развитии вещества); 2) какой элемент является конечным продуктом радиоактивного превращения.
Сравнивая массы радиоактивных элементов, ученые установили, что 39 радиоактивных элементов по своему происхождению не составляют единого ряда, а могут быть разделены на три радиоактивных семейства, названных по родоначальному элементу семейством урана, или семейством (4n + 2)*, актиноурана (4n + 3) и тория (4n). Из урана при последовательном радиоактивном распаде образуется 14 промежуточных радиоактивных элементов (включая уран в семействе 15 элементов), из актиноурана - 12 (в семействе 13), а из тория - 10 (в семействе 11 радиоактивных элементов). Общая характеристика радиоактивных семейств показана в табл. 18.
* (При делении значений относительных масс всех элементов данного семейства на четыре в остатке получается число два, потому его называют семейством "четыре эн плюс два" (4n + 2).)
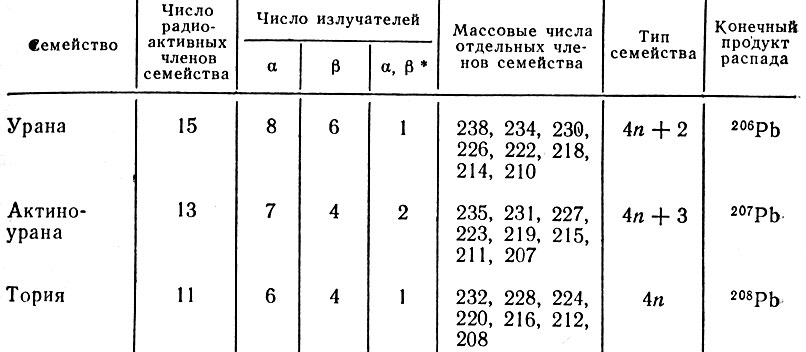
Таблица 18. Характеристика радиоактивных семейств
* (Часть атомов излучает только α-лучи, а другая часть - только β-лучи.)
Было показано, что конечным продуктом распада всех трех радиоактивных семейств является один и тот же элемент - свинец. Однако полученные атомы этого элемента в зависимости от того, какое семейство их "породило", обладают различной относительной массой, хотя химические свойства их одинаковы*. Такие разновидности атомов элемента получили название изотопов. Изотопы данного элемента должны располагаться в одной клетке периодической системы. Оказалось, что 39 радиоактивных элементов, о которых упоминалось выше, являются лишь изотопами 10 элементов и теперь не составляло труда разместить их в 10 клетках периодической системы (от висмута до урана).
* (Потребовалось около 30 лет, чтобы доказать высказанную впервые А. М. Бутлеровым мысль о неравноценности масс атомов одного и того же элемента.)
Открытие изотопов показало, что атомный вес является переменной характеристикой данного элемента и не она определяет природу элемента. Это подтверждается существованием и зоба ров - разновидностей элементов с различными химическими свойствами, но одинаковыми относительными массами. В частности, изобары получаются при β-распаде радиоактивных изотопов. Например, RaC и RaC' имеют одинаковые относительные массы, но обладают разными химическими свойствами, что согласуется с их положением в разных группах периодической системы.
Новая количественная характеристика элементов, определяющая их природу, была выявлена в 1913 г. английским физиком Мозли при исследовании характеристического спектра рентгеновских лучей. Такой характеристикой оказалась величина положительного заряда ядра атома. Выяснилось, что элементы в периодической системе размещаются в порядке возрастания величины заряда ядра; эту характеристику стали называть порядковым номером элемента и обозначать Z. Все изотопы данного элемента независимо от их относительных масс имеют один порядковый номер. Например, для изотопов свинца Z = 82. Принято при символической записи элемента свинца число, соответствующее порядковому номеру, ставить слева внизу символа элемента, а число, обозначающее относительную массу - слева вверху. Последнюю величину стали называть массовым числом. Тогда изотопы свинца можно записать следующим образом: 20682Pb, 20782Pb, 20882Pb.
Новая характеристика элементов помогла объяснить ряд вызывавших вопросы и оставшихся неясными положений, использованных Д. И. Менделеевым при построении его периодической системы. Так, было подтверждено, что между водородом (Z = 1) и ураном (Z = 92) в системе должно располагаться только 90 элементов. Получило подтверждение правильное распределение Д. И. Менделеевым трех пар элементов 18Ar - 19K, 27Сo - 28Ni, 52Те - 53I, в которых, вопреки первоначальной формулировке периодического закона, более легкий элемент стоит за более тяжелым. С другой стороны, стало ясным, что в противоположность мнению Менделеева, предполагавшего открытие в будущем легкого галогена с атомным весом 3, между водородом и гелием не должно быть ни одного элемента, так как ZH = 1, a ZHe = 2.
Опираясь на новую характеристику элементов, Мозли указал, что в периодической системе остаются незанятыми клетки 43, 61, 72, 75, 85 и 87, т. е. элементы с этими номерами еще предстоит открыть, так как ни один из известных в то время элементов не давал рентгеновские спектры, характерные для элементов с зарядами ядер, равными этим порядковым номерам. В связи с введением понятия порядкового номера элемента была принята новая формулировка периодического закона:
"Химические свойства элементов, а также состав и свойства соединений, образуемых ими, находятся в периодической зависимости от порядкового номера элементов".
Однако знание порядкового номера еще не давало возможность вскрыть причину периодического изменения свойств элементов, так как порядковый номер, так же как и атомный вес от первого к последнему элементу изменяется линейно.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'