
Элементы - окислители и сродство к электрону
Элементы, атомы которых при химических реакциях принимают электроны (акцепторы электронов), называются окислителями. Они содержат во внешнем уровне от четырех до семи электронов. Принимая электроны, эти атомы переходят в отрицательное валентное состояние (некоторые - в отрицательные ионы) по схеме
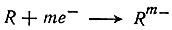
К окислителям относятся все p-элементы, кроме благородных газов и четырех элементов IIIA-группы (алюминия, галлия, индия и таллия). Сюда следует отнести также водород, атом которого может принять один электрон. В этом отношении водород аналогичен галогенам; поэтому в периодической таблице (см. табл. 26) он помещен в VIIA-группу.
Присоединение электрона сопровождается выделением энергии. Количество энергии, выделяющейся при присоединении электрона к атому, называется сродством к электрону, Е (ккал/г-атом или эв/атом). Следует отметить, что экспериментально полученные значения Е несколько различаются, поэтому ниже приведены средние величины Е (в эв/атом):

В закономерном изменении величин Е есть ряд отступлений (для N и Р). Однако в общем сродство к электрону возрастает в периодах слева направо (2 и 3 периоды) и, следовательно, от элемента к элементу увеличивается окислительная активность. Из указанных данных следует, что наиболее активным окислителем является нейтральный атом хлора. Если сравнивать окислительную активность молекулярного фтора и хлора (F2 и Сl2), то первый активнее второго, так как энергия разрыва молекулы на атомы у фтора меньше, чем у хлора, а энергия образования связей X-F больше, чем у X-Сl. Но в отличие от других p-элементов, фтор является только окислителем, что связано с высоким значением энергии ионизации, тогда как другие элементы VIIA-группы могут проявлять не только окислительные, но и восстановительные свойства. Например, водород и иод обладают двойственной химической природой:
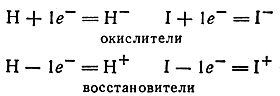
Наличие на кривых зависимости ионизационных потенциалов и радиусов от порядкового номера максимумов и минимумов объясняется закономерностями построения электронной оболочки атомов, а также экранированием ядра атома электронами, т. е. ослаблением его взаимодействия с внешними электронами. Экранирование зависит от типа электронов: s- и р-электроны сильно экранируют ядро, а d-электроны - очень слабо.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'