
Химические свойства нейтральных атомов
Элементы - восстановители и энергия ионизации
Наиболее характерными химическими свойствами нейтральных атомов являются окислительно-восстановительные. Восстановителями называются элементы, атомы которых при химических реакциях отдают электроны (доноры электронов). На внешнем уровне этих атомов содержится 1, 2 или 3 электрона. К типичным восстановителям относятся s-элементы (кроме Н и Не), d-, f- и четыре p-элемента из IIIA-группы (алюминий, галлий, индий и таллий).
При потере электронов атомы-восстановители (обозначим их условным символом Me) переходят в положительные ионы:
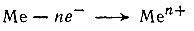
Чтобы оторвать электрон от атома, необходимо затратить энергию, называемую энергией ионизации. Энергия ионизации выражается в электрон-вольтах (эв). Ионизационным потенциалом (I) называется напряжение электрического поля в вольтах (в), при котором атом превращается в положительный ион. Ионизационный потенциал численно равен энергии ионизации. Следует различать первый (I1), второй (I2), третий (I3), ..., N-ый (In) ионизационные потенциалы, отвечающие отрыву первого, второго, третьего, ..., N-го электрона от атома. Чем легче электрон отрывается от атома, тем меньше величина ионизационного потенциала.
Следовательно, ионизационный потенциал является одной из основных количественных характеристик восстановительных свойств нейтральных атомов.
Сравним величины I1 трех элементов, стоящих рядом в таблице Менделеева, например лития, бериллия и бора (табл. 29). Как видно, от атома лития относительно легко отрывается один внешний электрон, от атома бериллия - два и от атома бора - три внешних электрона (см. жирную зигзагообразную линию).*
* (Энергия отрыва электронов каждого следующего внутреннего уровня значительно превышает энергию отрыва электронов внешнего уровня, что служит экспериментальным доказательством "слоистости" структуры электронной оболочки атомов.)

Таблица 29. Ионизационные потенциалы лития, бериллия и бора, в
Если построить график зависимости значений I1 для атомов всех элементов от их порядкового номера, то как видно (рис. 9), ионизационные потенциалы меняются периодически, достигая максимального значения через 8, 8, 18, 18 и 32 элемента. В точках максимума на кривой расположены благородные газы, самые слабые восстановители, а в точках минимума - атомы щелочных металлов, наиболее сильные восстановители. Таким образом, восстановительные свойства элементов изменяются периодически. В периодах, от атома щелочного металла к атому благородного газа, восстановительные свойства элементов ослабевают, что подтверждается увеличением значений I1. В пределах каждого периода участок кривой выражается не прямой линией, а ломаной, что свидетельствует о сложной зависимости: между I1 и Z. Например, во втором периоде ионизационный потенциал I1 элементов изменяется следующим образом:
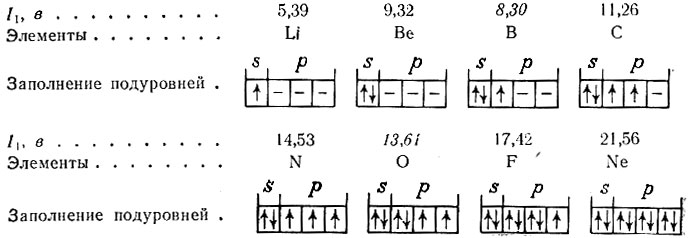
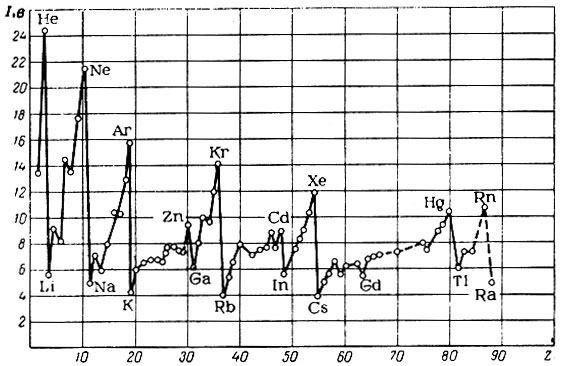
Рис. 9. Зависимость значений ионизационных потенциалов (I1) элементов от их порядкового номера (Z)
Для бора и кислорода величины ионизационных потенциалов уменьшаются. Это объясняется тем, что отрыв одного непарного р-электрона от атома бора происходит легче, чем s-электрона с заполненного s-подуровня атома бериллия. Точно также энергия отрыва одного парного p-электрона атома кислорода меньше энергии отрыва одного электрона с наполовину заполненного p-подуровня атома азота. Отрыв электронов с полностью заполненного подуровня требует значительной энергии. Именно наличием замкнутых электронных группировок в атомах
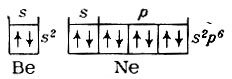
объясняется большая величина их ионизационных потенциалов. Подобные отклонения от линейной зависимости I = f(Z) наблюдаются и у элементов других периодов.
Величина ионизационного потенциала зависит не только от того, как располагаются электроны по уровням и орбиталям, но также и от радиуса атома, причем в значительной мере. В одном и том же периоде атомы элементов имеют одинаковое число электронных уровней, но с увеличением заряда ядра увеличиваются силы притяжения и атом как бы сжимается, т. е. радиусы атомов в периоде уменьшаются, ионизационные потенциалы возрастают, а восстановительные свойства ослабевают.
Следует отметить, что, говоря о радиусах атомов, имеют в виду кажущиеся атомные радиусы, определяемые из расстояния между центрами атомов в кристаллах элементарных веществ (при этом предполагается, что атомы, имеющие шаровую форму, соприкасаются своими сферами). Как и следовало ожидать, кажущиеся радиусы атомов должны изменяться периодически в зависимости от порядкового номера (рис. 10). На кривой в точках максимума расположены атомы щелочных металлов, отстоящие один от другого на 8, 8, 18, 18 и 32 места. В длинных периодах изменение величин радиусов атомов характеризуется сложной кривой; относительно меньшие радиусы отвечают атомам d-элементов.
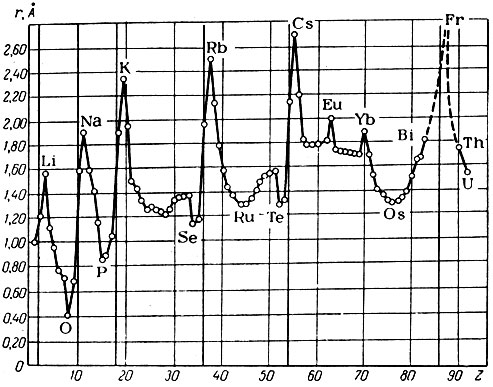
Рис. 10. Зависимость кажущегося радиуса атома (r) от порядкового номера элемента (Z)
Во всех группах с индексом А, в группе IIIB и у f-элементов радиусы атомов увеличиваются сверху вниз, значения ионизационных потенциалов уменьшаются, соответственно возрастают и восстановительные свойства их. Например, для элементов IA-группы значения r и I1 изменяются так:

Цезий является наиболее сильным восстановителем.
В группах d-элементов, кроме IIIB-группы (например, в VIB-группе), значения I1 сверху вниз возрастают: Сr - 6,76; Мо - 7,10; W - 7,99, соответственно ослабевают и восстановительные свойства.
Таким образом, величина ионизационного потенциала зависит от следующих факторов: заряда его ядра, радиуса атома, строения электронной оболочки (наличия во внешнем уровне непарных и парных электронов, экранирования внешнего электрона остальными электронами атома).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'