
Периодическая система элементов и структура электронной оболочки атомов
Как указывалось выше, элементы в периодической системе располагаются в последовательности возрастания Z от 1 до 105, но эта закономерность еще не объясняет природы периодичности. Современная формулировка периодического закона гласит:
Периодическое изменение свойств элементов зависит от периодического повторения подобных структур электронной оболочки атомов.
Следовательно, в основе конструкции периодической системы лежит структура атомов. Если исходить из положения, что в атоме электроны стремятся занять наиболее низкие энергетические уровни и подуровни, то последовательность их заполнения должна быть такой: уровней - 1, 2, 3, 4, 5, 6, 7; подуровней - s, р, d, f: в целом - 1s, 2s2p, 3s3p3d, 4s4p4d4f, 5s5p5d5f ..., 6s6p6d ..., 7s7p ....
Действительно, именно в такой последовательности заполняются уровни и подуровни в атомах элементов от 1 до 18 включительно, составляющих три первых (коротких) периода в системе (табл. 21).
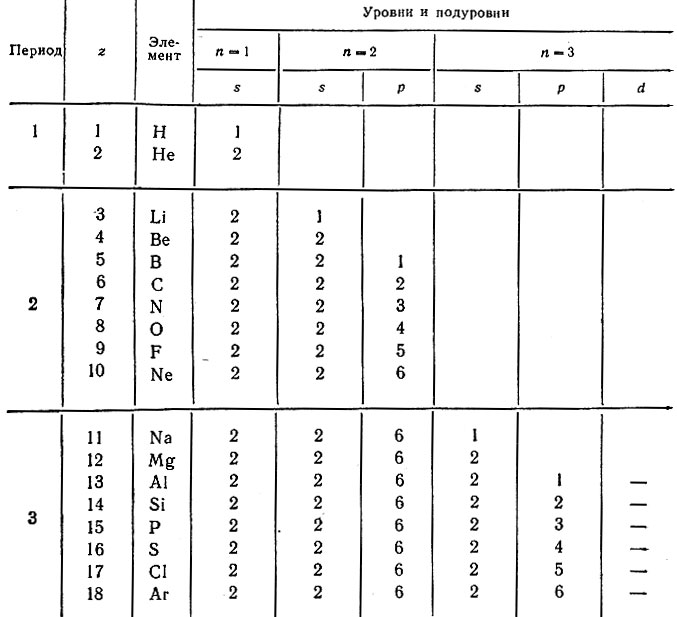
Таблица 21. Распределение электронов в атомах элементов 1-, 2- и 3-го периодов системы
Периоды начинаются элементами, в атомах которых на новом уровне появляется первый s-электрон (водород и щелочные металлы), а заканчиваются атомами благородных газов, содержащих на внешнем уровне два s-электрона (Не), два s- и шесть p-электронов (Ne, Аr). Первый период включает два элемента, а второй и третий периоды - по восьми элементов. Если бы все электронные уровни состояли из двух подуровней (s2p6), то число элементов в любом периоде должно было быть только 8 = 2 + 6 и это соответствовало бы идеальной восьмиклеточной таблице периодической системы.
У атома 18-го элемента-аргона все подуровни, кроме 3d-подуровня, полностью заполнены. У атома следующего за ним девятнадцатого элемента - калия, казалось бы, должен заполняться электроном 3d-подуровень, а в действительности, как мы уже знаем, заполняется 4s-подуровень. Это объясняется тем, что некоторые подуровни различных уровней имеют близкие энергетические характеристики (рис. 7). К таким подуровням относятся: 4s- 3d, 5s - 4d, 6s - 5d - 4f и 7s - 6d - 5f. Для этих подуровней характерна своеобразная энергетическая "конкуренция", обусловленная притяжением электронов к ядру и отталкиванием его всеми остальными электронами.
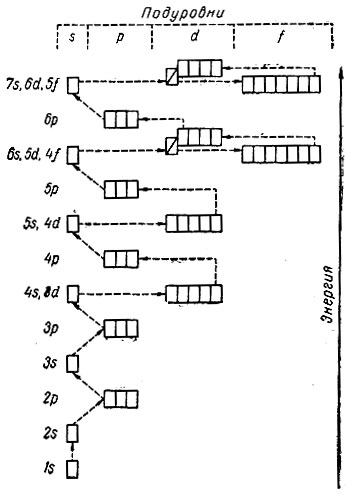
Рис. 7. Энергетические характеристики подуровней
Электрону атома калия энергетически выгоднее расположиться на 4s-подуровне. В атоме кальция (Z = 20) два электрона также помещаются на том же подуровне. Только с атома 21-го элемента - скандия начинает заполняться пропущенный ранее 3d-подуровень (табл. 22). Известно, что максимально на d-подуровне может разместиться 10 электронов, следовательно, полностью этот подуровень заполнится лишь у атома цинка (Z = 30). От 31 до 36-го элементов в атомах идет заполнение 4р-подуровня. В связи с тем, что в 4-м периоде происходит заполнение не только 4s- и 4p-подуровней, но и 3d-подуровня, число элементов в нем возрастает до 18. В 4-м уровне остаются незаполненными 4d- и 4f-подуровни.
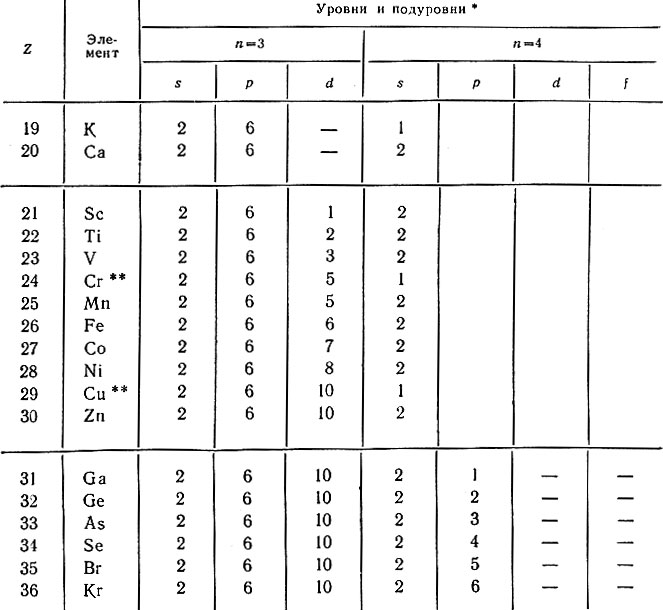
Таблица 22. Распределение электронов в атомах элементов 4-го периода
* (Уровни n = 1 и n = 2 в таблице не показаны, так как они у всех атомов построены одинаково (1s2 2s2p6).)
** (Отмечены случаи аномального заполнения подуровней; во внешнем подуровне не два, а только один электрон (см. стр. 72).)
Аналогичное построение имеет 5-й период, содержащий также 18 элементов от 37 (рубидия) до 54-го (ксенона). У атомов элементов этого периода первые четыре уровня построены одинаково (1s22s22p6 3s23d103p6 4s24p6). Однако у атомов первых двух элементов этого периода - рубидия и стронция - происходит заполнение не 4d-подуровня, а 5s-подуровня, затем, начиная с иттрия, пополняется пропущенный ранее 4d-подуровень и только с индия начинает заполняться 5p-подуровень (табл. 23). У шести элементов данного периода наблюдается аномальное заполнение подуровней в их атомах, а именно: Nb, Mo, Ru, Rh, Ag имеют на внешнем уровне по одному электрону, а у атома Pd на 5s-подуровне электроны отсутствуют. У атома этого элемента число электронных уровней равно четырем, хотя он находится в 5-м периоде (единственное исключение в системе!). У атомов элементов этого периода не заполняются электронами 4f-, 5d- и 5f-подуровни.
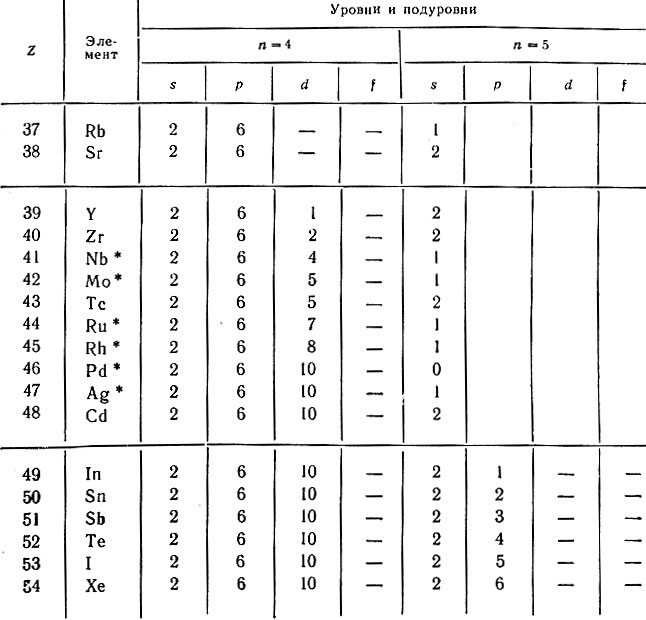
Таблица 23. Распределение электронов в атомах элементов 5-го периода
* (Отмечены случаи аномального заполнения электронами подуровней.)
В 6-м периоде в атомах 55 и 56-го элементов застраивается 6s-подуровень одним и двумя электронами соответственно. У следующего 57-го элемента (лантана) один электрон помещается на 5d-подуровне (на рис. 7 эта орбиталь отмечена диагональной чертой), а с 58 до 71-го элемента постепенно заполняется пропущенный 4f-подуровень (f14), причем 5й-электрон сохраняется только в атомах Gd (Z = 64) и Lu (Z = 71). Затем у атомов с 72-го по 80-й элемент достраивается ^-подуровень с аномальным заполнением у Pt и Аu, а с 81-го по 86-й -6p-подуровень. Следовательно, в результате заполнения четырнадцатью электронами 4f-подуровня в шестом периоде число элементов увеличивается до 32 (табл. 24).
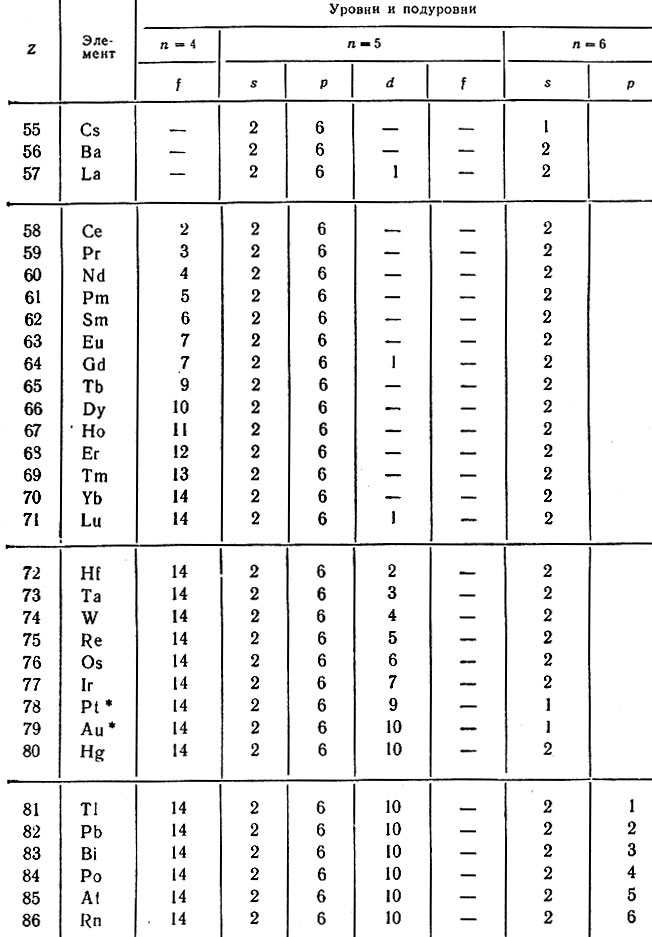
Таблица 24. Распределение электронов в атомах элементов 6-го периода
* (Отмечены случаи аномального заполнения электронами подуровней.)
Седьмой период полностью не завершен, в нем известно пока только 19 элементов - от 87 до 105-го. Конструктивно этот период построен аналогично шестому периоду. Для тория еще не доказано наличие в его атоме 5f-электронов*: для него принята электронная конфигурация 6d27s2. Элементу с Z = 104, полученному в лаборатории ядерных исследований в г. Дубне, руководимой академиком Г. Н. Флеровым, предложено название "курчатовий" (Кu) в честь известного советского физика И. В. Курчатова. Недавно в СССР и в США получен искусственно элемент с Z = 105. Его предложено назвать "ганий" - На (США) и "нильсборий" - Ns (СССР); окончательное название еще не утверждено.
* (Американскому ученому Кенингему удалось обнаружить 5f-электрон в ионе Th3+.)
Схема последовательности заполнения электронных уровней и подуровней позволяет составить принципиальную конструкцию таблицы периодической системы как классификации атомов по структуре их электронных оболочек (табл. 25).
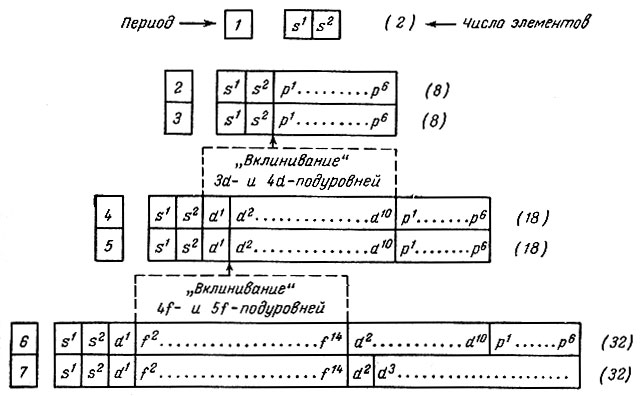
Таблица 25. Схема конструкции периодической системы на основе структуры электронных оболочек атомов
Так как максимальная емкость периодов соответствует 32 элементам, то естественной формой таблицы периодической системы должна быть 32-клеточная (табл. 26), включающая 105 элементов.
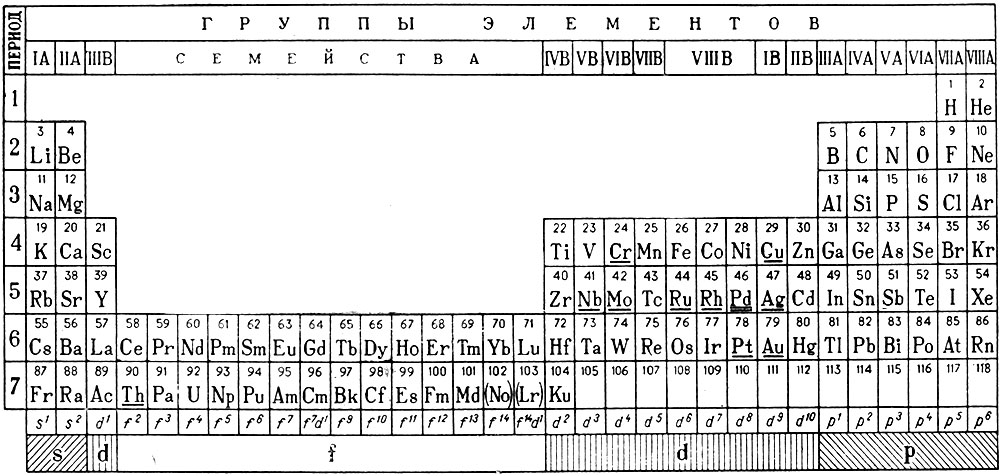
Таблица 26. Периодическая система химических элементов Д. И. Менделеева (длиннопериодный вариант)
В таблице, как и в графике на плоскости, следует различать два направления: горизонтальное (периоды) и вертикальное (группы).
В периодической системе семь периодов. Номер периода указывает на число электронных уровней в атомах элементов (исключение для 46-го элемента отмечено выше). Все периоды, кроме первого, попарно содержат одинаковое число (X) элементов, которое можно определить по формулам, предложенным В. М. Клечковским:
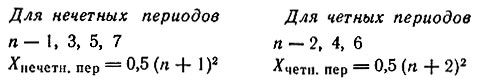
В системе четко выделяются четыре типа элементов: s-, p-, d- и f-элементы, характеризующиеся не только сходством свойств элементов, принадлежащих одной группе (сходство по вертикали), но и рядом специфических свойств, общих для всех элементов данного типа (сходство по горизонтали). В каждом периоде первые два элемента относятся к s-типу (их всего 14, в том числе Н и Не). Во втором - шестом периодах последние шесть элементов принадлежат к р-типу (их 30). В четвертом - седьмом периодах располагаются d-элементы (их 33); в шестом - седьмом периодах заняли надлежащее место 28 f-элементов (см. табл. 26).
В вертикальном направлении в группах расположены элементы-аналоги как по химическим свойствам, так и по структуре электронной оболочки атомов. Так как элементы-аналоги последующих периодов отстоят от элементов-аналогов предыдущих периодов на 8, 8, 18, 18 и 32 места, то через столько же элементов должно происходить периодическое "повторение" свойств. Например, в группе IV А атомы элементов углерода, кремния, германия, олова и свинца различаются числом энергетических уровней, но не различаются по распределению электронов на внешнем уровне, т. е. обладают одинаковой конфигурацией внешнего электронного уровня, - s2p2. В системе нет больше ни одного элемента, в атоме которого была бы указанная конфигурация внешнего электронного уровня.
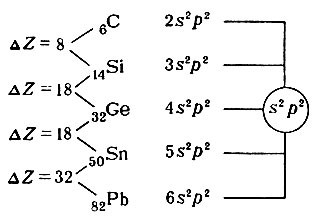
Группы нумеруются двояко: группы s- и p-элементов римскими числами с литерой "А", а d-элементов - с литерой "В". Номер группы соответствует числу внешних или валентных электронов в атоме. Элементы f-типа - лантаноиды (58-71) и актиноиды (90-103) - характеризуются переменной валентностью, первые от двух до четырех, а вторые - от двух до семи (недавно в СССР получены семи валентные соединения нептуния и плутония). Они представляют два семейства и не отнесены к каким-либо группам. Элементы групп кобальта и никеля, проявляющие валентность от двух до шести, но не выше, включены условно в VIIIB-группу, хотя для этого нет убедительных оснований. Их иногда, вместе с элементами группы железа, называют триадами, так как в каждом периоде (4-, 5- и 6-м) в VIIIB-группу отнесено по три элемента. Для элементов "нулевой" группы принято обозначение VIIIA, так как за последние десять лет синтезировано большое число соединений этих элементов и в некоторых из них валентность достигает значения восьми. К этой группе относят и гелий, хотя, в отличие от других благородных газов, он является элементом s-типа.
В атомах d-элементов, как правило, на внешнем уровне содержится по два электрона за исключением тех элементов, которые в таблице подчеркнуты одной чертой. У последних наблюдается энергетически выгодный "провал" одного электрона с внешнего уровня на d-подуровень внутреннего соседнего уровня, что происходит при достройке этого подуровня до пяти или десяти электронов, т. е. до состояния, когда все орбитали заняты каждая одним (половина максимальной емкости) или когда они заняты каждая парой электронов (максимальная емкость подуровня). В атоме палладия (Z = 46) происходит "двойной провал" электронов - его символ в таблице подчеркнут двумя чертами. Поэтому у атомов d-элементов - аналогов электронная структура валентных подуровней не всегда тождественна. Так, У атомов элементов VIB-группы Cr, Mo, W она различна: 3d54s1, 4d55s1 и 5d46s2, соответственно. Этим различием в строении электронной оболочки обусловлены некоторые особенности их химических свойств, но характеристичная валентность, определяемая суммарным числом электронов s-, d-типа, у всех атомов одинакова и равна шести.
Структура валентных электронных уровней у атомов элементов IIB-, IIIB-, IVB- и VIIB-групп одинакова.
Об особенностях структуры электронных оболочек атомов лантаноидов и актиноидов будет сказано ниже.
Таким образом, становится ясным, что идеальная последовательность заполнения электронами оболочки атома по возрастающему значению главного квантового числа n в действительности распространяется лишь на элементы первых трех периодов от водорода (Z = 1) до аргона (Z = 18). Эта последовательность полностью отвечает принципу Паули и получила название идеальной схемы заполнения.
Начиная с 19-го элемента - калия, несмотря на то что в его атоме 3d-подуровень остается вакантным, последний электрон; занимает 45-подуровень. Этот же подуровень заполняется вторым электроном в атоме кальция (Z = 20). Только с атома 21-го элемента - скандия - начинает заполняться вакантный 3d-подуровень (табл. 27).

Таблица 27. Заполнение электронами внешних подуровней атомов элементов с Z, равным 18, 19, 20 и 21
Реальная схема заполнения электронных оболочек атомов, начиная с калия, подвергает сомнению доминирующую роль главного квантового числа n.
Советский ученый В. М. Клечковский предложил распределять электроны в атоме по сумме главного (n) и орбитального (l) квантовых чисел, т. е. по (n + l), названной им группой или состоянием.
С увеличением порядкового номера электроны в атоме заполняют квантовые уровни последовательно, начиная с групп уровней с меньшим значением суммы (n + l) до групп с большим значением:
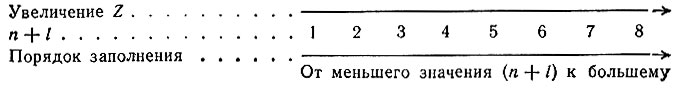
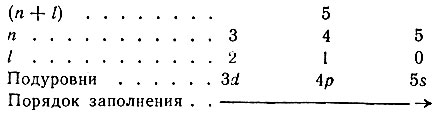
В пределах одной группы (n + l) подуровни заполняются от меньшего значения n и большего значения l к большему значению n и меньшему значению l. Например, для группы (n + l) = 5 порядок заполнения электронами подуровней выполняется в направлении слева направо:
В атомах элементов отдельно взятого периода происходит заполнение s-подуровня со значением (n + l), равным номеру периода, а всех остальных подуровней со значением (n + l), на единицу большим номера периода:

На основании этих элементарных правил В. М. Клечковского определена последовательность заполнения электронами подуровней в атомах всех элементов:
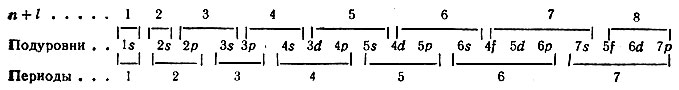
Учитывая максимальную емкость подуровней s2, p6, d10, f14, получим следующие числа элементов в периодах: 2, 8, 8, 18, 18, 32 и 32. Эти числа могут быть найдены и по формулам В. М. Клечковского, о чем упоминалось раньше.
В. М. Клечковский предложил формулу для определения порядкового номера элемента Zl, в атоме которого появляется первый электрон с данным орбитальным квантовым числом l. Используя ее применительно к двум первым электронам (2)Zl, заполняющим данный подуровень в атомах, автор по формуле
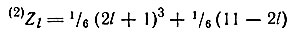
установил, что такими элементами являются 2Не, 6С, 22Ti, 58Ce. Действительно, в атомах этих элементов появляются первые два s(He), два p(С), два d(Ti) и два f(Се) электрона. Особенно важно это для церия, так как этим было подтверждено, что в его атомах содержатся два f-электрона, а не один, как предполагали раньше.
Однако нахождение Zl есть лишь частный случай более общей задачи о связи порядкового номера (Z) с числом электронов (Ni), занимающих в невозбужденном атоме уровни с данным орбитальным квантовым числом. Нахождение начала (ах) и конца (bх) заполнения электронами данного подуровня сводится к определению координат точек (рис. 8), отвечающих определенным значениям Z(ax), Z(bx) и Nl, где Nl = (bx) - (ах) - суммарное число электронов в данном подуровне. Пользуясь системой из двух уравнений, отдельно для четных и нечетных значений х (х = 1, 2, ..., 7), Клечковский показал, что можно легко вычислить значения порядковых номеров тех элементов, в промежутке между которыми должен заполняться в атоме подуровень с данным l (l = 0, 1, 2, 3). Уравнения для четных х:
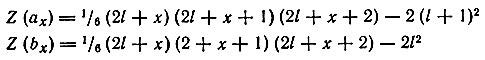
Уравнения для нечетных х:
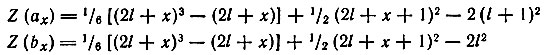
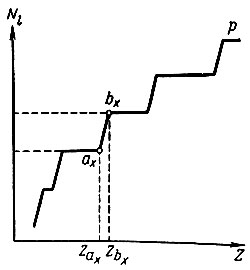
Рис. 8. Координаты начала и конца заполнения подуровней электронами
Вычисленные по этим формулам и фактические значения Z вполне удовлетворительно согласуются (табл. 28).
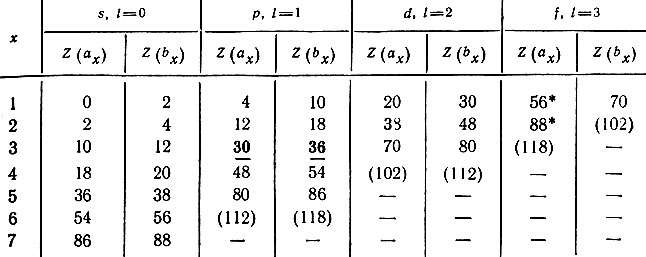
Таблица 28. Граничные значения Z при данном l по В. М. Клечковскому
Любая пара соседних чисел показывает границы комплектования электронами определенного подуровня в атомах. Например, числа 30 и 36 (они набраны жирным шрифтом) означают, что первый р-электрон появляется в атоме следующего 31-го элемента - галлия, а полное заполнение р-подуровня шестью электронами заканчивается в атоме 36-го элемента - криптона.
Числа, отмеченные звездочкой, обнаруживают несоответствие между вычисленными и фактическими значениями. Первые f-электроны появляются в атомах 58 и 91-го элементов, а не 57 и 89-го, непосредственно следующих за 56 и 88-м. Истинная последовательность заполнения электронами подуровней в 6-м уровне такова - 6s25d14f145d2-106p6 и отличается от последовательности 6s24f145d106p6, найденной В. М. Клечковским.
Кроме того, как было показано выше, известны отступления от закономерного заполнения электронами подуровней, вследствие "провала" электронов (см. подчеркнутые символы в табл. 26).
Если раньше считали, что энергетическое состояние электрона в многоэлектронном атоме определяется значением главного квантового числа n, то в работах В. М. Клечковского было показано:
"...В периферической части электронной оболочки многоэлектронных атомов вместе с увеличением числа экранирующих электронов зависимость энергетического уровня от орбитального квантового числа l настолько возрастает, что в ряде случаев уровни с большим n, но малым l оказываются энергетически выгоднее уровней с меньшим значением n, но большим l"*.
* (Клечковский В. М., Распределение атомных электронов и правило последовательного заполнения (n + l)-групп, Атомиздат, 1968, стр. 23.)
Правило В. М. Клечковского - правило последовательного заполнения электронами (n + l)-групп - является серьезным теоретическим обоснованием периодической системы Д. И. Менделеева.
Важное значение для химии имеет понятие о конфигурационном индексе (2εк), впервые введенное В. М. Клечковским. Величина εк - характеризует число электронов, недостающих до полного заполнения всех начатых заполняться (n + l)-групп в основном состоянии атома. Рассмотрим величину εк для атома бора, имеющего электронную конфигурацию 1s22s22p1:

Среди других элементов периодической системы аналогами бора будут те, которые имеют конфигурационный индекс, равный 7. К таковым относятся: алюминий, галлий, индий и таллий, которые вместе с бором составляют IIIA-группу элементов.
До сих пор принималось, что химические аналоги являются в то же время электронными аналогами. Для большинства элементов это утверждение является справедливым, так как у их атомов электронная конфигурация одинакова (различны только значения главных квантовых чисел). Однако у ряда химических аналогов электронные конфигурации могут различаться. К таким элементам, как мы уже знаем, относятся хром (3d54s1), молибден (4d55s1) и вольфрам (5d46s2). Несмотря на то что электронные конфигурации указанных атомов отличаются, они являются химическими аналогами. Это подтверждается тождественным значением их конфигурационного индекса - 14.
Из 105 известных элементов В. М. Клечковский отмечает 18 отклонений от его правила, определяющего электронную конфигурацию атомов и, соответственно, значение конфигурационного индекса. Например, конфигурационный индекс лантана и актиния принят равным 31 с учетом того, что в их атомах имеется по одному f-электрону, а в действительности эти атомы не содержат электронов данного типа: их электронная конфигурация - d2s1.
Установление сложной структуры электронной оболочки атомов позволило выявить новые, ранее неизвестные характеристики и свойства: например, энергию ионизации, сродство к электрону, радиус атома и др.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'