
Водород
Водород по электронной конфигурации атома (1s1) относится к s-элементам, а потому до недавнего времени его обычно включали в первую группу периодической системы. Водород, как и щелочные металлы, одновалентен и проявляет восстановительные свойства. Атомы щелочных металлов и водорода, теряя по одному электрону, должны переходить в положительные ионы. Действительно, кристаллические решетки соединений щелочных металлов относятся к ионному типу, но неизвестно ни одного соединения ионного типа, содержащего ион Н+ (водород образует соединения с ковалентными - неполярными или полярными - типами связи). Обычно указывают на наличие ионов Н+ в кислотах, но растворы последних содержат гидратированные ионы водорода - Н+·Н2O или Н3O+ (гидроксоний-ион). Отличает водород от щелочных металлов и его способность проявлять окислительные свойства.
В гидридах, соединениях водорода с металлами (NaH, СаН2), водород находится в виде отрицательного иона Н-, что "роднит" его с галогенами, образующими с металлами галиды (Na+Cl-, K+F- и др.).
Если сравнить ряд свойств водорода, лития и натрия, фтора и хлора (табл. 30), то нетрудно видеть, что большинство свойств водорода ближе к свойствам галогенов, чем к свойствам щелочных металлов.
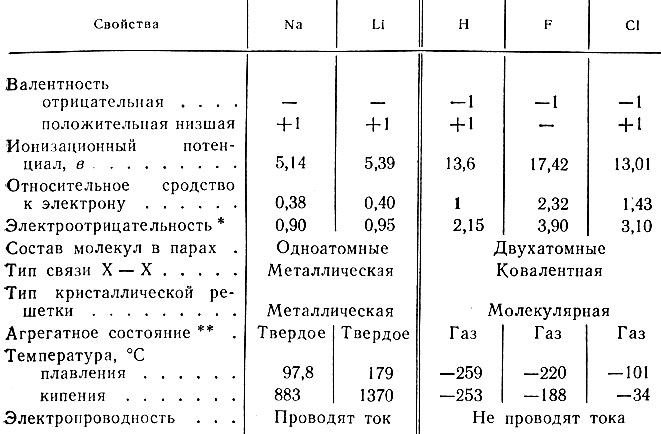
Таблица 30. Сравнение некоторых свойств водорода, натрия и лития, фтора и хлора
* (Электроотрицательность (ЭО), равная полусумме энергии ионизации и сродства к электрону, приближенно выражает энергию притяжения данным атомом связующих электронов. Наибольшее значение ЭО имеет атом фтора.)
** (Нормальные условия.)
К тому же выводу можно прийти, сравнивая энергии кристаллических решеток фторидов и гидридов щелочных металлов (рассчитанные М. X. Карапетьянцем), теплоты испарения водорода и галогенов с теплотами испарения благородных газов, температуры кипения и теплоты испарения водорода и галогеноводородов и др.
Конечно, нельзя считать водород абсолютным аналогом галогенов, ибо водород обладает рядом специфических свойств, обусловленных особой структурой электронной оболочки его атома; у атома водорода нет внутренних электронных уровней.
Химическая природа водорода, в известной мере, двойственна. И все же более оправдано отнесение его к VIIA-группе периодической системы элементов, что и делается ныне в большинстве вариантов таблиц периодической системы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'