
Благородные газы
К благородным газам теперь относят гелий, неон, аргон, криптон, ксенон и радон, образующие VIIIA-группу периодической системы. Выделены они были позднее, чем Д. И. Менделеев открыл периодический закон и опубликовал свою систему, т. е. в конце XIX начале XX веков.
Гелий впервые был обнаружен в 1868 г. спектроскопическим методом при исследовании протуберанцев Солнца, а впоследствии он был выделен из ряда радиоактивных минералов при нагревании последних. Затем Рамзаю со своими учениками удалось из воздуха получить аргон, неон, криптон и ксенон.
Наконец, в 1900 г. стало известно о существовании нового газообразного элемента - радона. Попытки получения каких-либо соединений этих газов не дали положительных результатов и их назвали "инертными газами".
Открытие этих элементов внесло некоторое недоумение и казалось, на первых порах, наносило жестокий удар по незыблемости периодического закона. Д. И. Менделеев, абсолютно уверенный в правильности периодического закона и не находивший места для новых элементов в своей системе, сначала сомневался в их индивидуальности. Он писал:
"Но все же пока не будут получены какие-либо их соединения... нельзя быть совершенно уверенным в точном описании природы описываемых газов".
Отказавшись вначале от внесения этих "элементов" в систему, он впоследствии, по предложению Рамзая и Эрреры, ввел в систему "нулевую" группу, поместив в нее все инертные газы. До конца своих дней Менделеева не покидала уверенность в том, что инертные газы должны образовывать химические соединения. Он отмечал:
"... Я молчал, когда мне не раз выставляли аргоновые элементы (так Менделеев называл инертные газы. - В. С.), как укор периодической системе, потому что я поджидал, что скоро обратное всем будет видимо".
Пророчество Менделеева сбылось лишь в 1962 году.
Изучение электронной структуры оболочки атомов подтвердило необыкновенную устойчивость внешнего электронного уровня у атомов инертных газов, что объясняется замкнутостью его (суммарный спин электронов равен нулю):
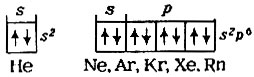
Отсутствие непарных электронов в атомах инертных газов объяснило невозможность образования ими соединений с ковалентной связью, т. е. неполярных или полярных молекул (кстати, этим же объясняется одноатомность их молекул). Их атомы обладают наибольшими значениями ионизационных потенциалов. Если невозможно при химических реакциях оторвать электрон от атома фтора (I1 = 17,42 в), то это тем более неосуществимо для следующего за фтором атома неона (I1 = 21,56 в). Отсюда следует, что атомы инертных газов неспособны образовывать соединения с ионными связями.
Таким образом, восемь электронов внешнего уровня атома или электронный октет символизировали особую устойчивость атомных и ионных структур. В 1916 г. Косселем было высказано положение, что атомы при химических реакциях, отдавая избыточные или приобретая недостающие электроны, стремятся принять электронную конфигурацию атома ближайшего инертного газа, другими словами, "имитировать" этот атом. Например, взаимодействие натрия с фтором сопровождается переходом электрона от атома натрия к атому фтора, причем образовавшиеся ионы приобретают электронную конфигурацию атома неона:
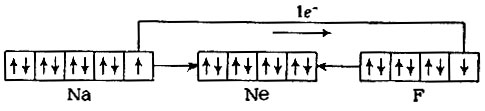
Электростатическое взаимодействие противоположно заряженных ионов Na+ и F- приводит к образованию ионной молекулы Na+F-. "Имитация" атомов инертного газа используется Льюисом для объяснения механизма образования ковалентной связи. Атомы хлора, имеющие во внешнем уровне по семь электронов, соединяются между собой, образуя из непарных электронов общую (поделенную) пару электронов, характерную для ковалентной связи; в молекуле хлора каждый атом окружен октетом электронов ("имитация" атома аргона):
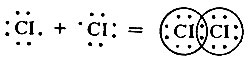
Несмотря на то что электронный октет не всегда соблюдается при образовании соединений, это положение было возведено в ранг какого-то "абсолюта". Именно из-за этого химики с уверенностью считали, что инертные газы не могут образовать соединений с ковалентными и ионными связями. Валентность их приравнивалась нулю.
И все же в 1962 г. канадскому ученому Бартлетту удалось получить первое ионное соединение ксенона Xe+[PtF6]-. Если сопоставить ионизационные потенциалы атомов инертных газов и соседних элементов:
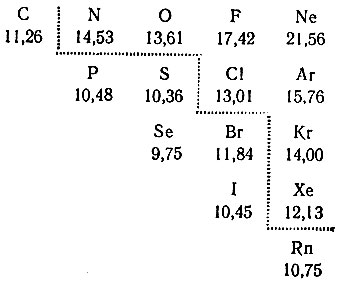
то видно (см. пунктирную линию), что у ксенона I1 меньше, чем у азота, от атома которого можно оторвать один электрон с образованием одноположительного иона N+. Следовательно, одноположительный ион Хе+ получить легче и надо только подобрать соответствующий сильный окислитель. В качестве такового Бартлетт избрал гексафторид платины (PtF6).
Впоследствии ученые ряда стран, в том числе и СССР, приступили к синтезу различных соединений инертных газов, изучению их строения, установлению природы химической связи в молекулах и исследованию различных свойств как физических, так и химических. За истекшие десять лет было получено большое число соединений криптона, ксенона и радона (табл. 31).

Таблица 31. Состав некоторых полученных соединений Кr, Хе и Rn
Соединения инертных газов представляют значительный практический интерес. Они могут быть использованы в качестве сильных окислителей, фторирующих агентов, а некоторые из них как взрывчатые вещества (ХеО3).
Из всех соединений инертных газов больше всего изучены фториды. В настоящее время их получают синтезом из фтора и соответствующего инертного газа, взятых в различных объемных соотношениях. При проведении синтеза варьируют температуру и давление. Обменными реакциями фторидов с водой (гидролиз) можно получить оксфториды, оксиды и кислоты, а нейтрализацией последних - соли.
По составу продуктов синтеза можно заключить, что инертные газы образуют соединения с валентностью, равной 2, 4, 6 и 8. До сих пор не получены соединения гелия, неона и аргона. Состав единственного фторида радона окончательно не установлен, так как из-за большой радиоактивности радона приходится работать с микроколичествами вещества.
Как правило, соединения, в которых элементы проявляют высокую валентность, обладают ковалентным типом связи. Для того чтобы атомы инертных газов, у которых в основном состоянии нет непарных электронов, вступали во взаимодействие, необходимо возбудить электроны, а это возможно только, если имеются свободные орбитали и на возбуждение затрачивается мало энергии. Легче всего возбуждаются атомы радона, труднее - аргона, а атомы гелия и неона возбудить нельзя, так как у них нет свободных орбиталей.
Таким образом, "инертность" этих элементов, обусловленная "необычайной" устойчивостью электронного октета, и нулевая валентность их (кроме гелия и неона) оказались иллюзорными. Термин "инертные газы" ныне заменен на термин "благородные газы", "аэрофилы" или "аэрогены" (но не один из этих терминов нельзя признать удачным). Так как для этих газов известны соединения с валентностью 8, они должны быть включены в VIIIA-группу периодической системы на правах полноправных элементов, обретших свою химическую индивидуальность.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'