
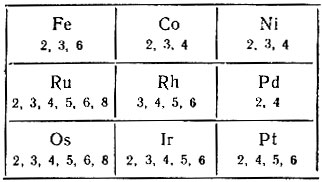
Триады элементов VIII группы
Осенью 1870 г. Д. И. Менделеев, исходя из необходимости размещения в больших периодах по 17 элементов в семи группах, ввел в новый вариант системы VIII группу с включением в нее трех триад элементов: Fe-Со-Ni (4-й период); Ru-Rh-Pd (5-й период) и Os-Ir-Pt (6-й период). В соответствии с номером группы эти элементы должны проявлять в соединениях характеристическую валентность, равную 8, и, в частности, образовывать с кислородом высший окисел типа RO4. В действительности только для рутения и осмия были получены соединения RuO4 и OsO4, отвечающие характеристической валентности этих элементов.
Что касается всех других элементов этой группы, то они в соединениях могут проявлять любую валентность, но не выше 6.
VIII группа
Можно было предположить, что для семи элементов из девяти соединения с максимальной валентностью не удавалось получить. Были предприняты (в 1926-1931 годах) экспериментальные работы по получению восьмивалентных соединений железа, кобальта и никеля. По началу даже казалось, что такие соединения получены, но вскоре эти результаты были опровергнуты. Невозможность получения таких соединений была впервые обоснована советским ученым Б. Ф. Ормонтом.
Первым должен быть решен вопрос: почему железо, в отличие от рутения и осмия, не образует восьмивалентных соединений?
Электронная конфигурация валентных подуровней этих атомов в основном и возбужденном состояниях следующая:
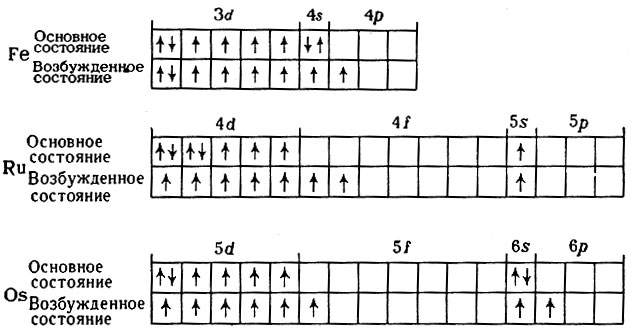
У всех этих атомов число валентных электронов равно 8. У атома железа, как элемента четвертого периода, свободных орбиталей в третьем энергетическом уровне нет, поэтому при возбуждении возможен лишь переход электронов с 4s-подуровня на свободную орбиталь 4p-подуровня, что приводит к образованию шести непарных электронов и максимальная валентность железа достигает значения 6. У атомов рутения и осмия остаются незаполненными внутренние 4f- и 5f-подуровни соответственно, поэтому для них возможно возбуждение не только с 5s- и 6s-подуровней на подуровни 5р и 6p, но и с 4d- и 5d-подуровней на 4f- и 5f-подуровни. Это тем более вероятно потому, что энергии соответствующих подуровней близки друг к другу (см. рис. 7). В результате такого двойного возбуждения в атомах появляется по восемь непарных электронов и элемент приобретает способность к проявлению валентности 8.
Требует ответа и второй вопрос: можно ли ожидать для кобальта и никеля соединений с максимальной валентностью? Из сопоставления электронных конфигураций атомов этих элементов в основном и возбужденном состояниях
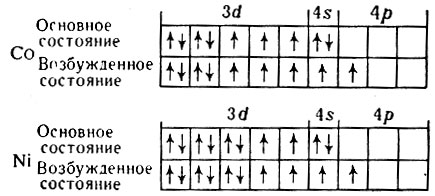
видно, что Со должен давать соединения с максимальной валентностью 5 (таких соединений в настоящее время неизвестно), а никель в соединениях может проявлять валентность 4. Элементы Со - Rh - Ir и Ni - Pd - Pt ни по своей максимальной валентности, ни по сумме d- и s-электронов, равной 9 и 10, никакого отношения к группе VIIIB не имеют, и поэтому в последнее время эти элементы в таблицах периодической системы выносят за контуры восьмой группы (см. табл. 34).
Естественно, что железо, как аналог рутения и осмия, оставляют в VIIIB-группе, хотя оно и не проявляет в своих соединениях валентность, отвечающую номеру группы.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'