
Валентность
В классическом представлении числовое значение максимальной положительной валентности элементов определяется номером группы и должно изменяться от единицы до восьми. Если исключить из рассмотрения лантаноиды и актиноиды, то для 18 из 76 элементов (23%) имеют место отступления (табл. 32):

Таблица 32. Элементы с максимальной валентностью, не равной номеру группы
К числу исключений прежде относили также бром, для которого не были известны соединения с валентностью, равной 7, но в 1968 г. был получен пербромат калия КВrO4 (валентность брома +7) из бромата калия (валентность +5) при действии сильным окислителем (озоном, дифторидом ксенона).
При рассмотрении ионизационных потенциалов I1 золота и ртути, соответственно 9,22 и 10,83 в, - элементов, стоящих в периодической системе друг за другом (Z = 79 и 80), обращает внимание резкое повышение значения I1 для ртути. Это объясняется образованием во внешнем уровне атома ртути замкнутой электронной группировки s2, состоящей из двух электронов с аитипараллельными спинами, получившей название "инертной пары". Наличием "инертной пары" и объясняется небольшая химическая активность ртути. У атомов последующих элементов с Z от 81 до 86 "инертная пара" сохраняется. Хотя атомы элементов от 81 до 83 проявляют максимальную валентность, отвечающую суммарному числу электронов на внешнем уровне, но наиболее устойчивыми* их соединениями являются те, в которых валентность на две единицы меньше, а элементы 84, 85 и 86 не проявляют в соединениях своей максимальной валентности.
* (Числа в скобках отвечают наиболее устойчивой валентности в соединениях.)
Действительно, у таллия наиболее устойчивы соединения с валентностью +1, а у свинца - с валентностью +2; многообразны и устойчивы соединения трехвалентного висмута. Наличие инертной пары объясняет максимальную валентность полония, равную четырем, астата - пяти. По-видимому, для радона возможны лишь шестивалентные соединения, а соединений с валентностью +8 ожидать трудно.
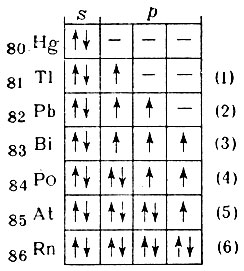
Отсутствие у азота (2s22p3), кислорода (2s22p4) и фтора (2s22p5) соединений с валентностью, отвечающей номеру группы (V, VI и VII), объясняется невозможностью возбуждения электронов, так как на внешнем уровне атомов этих элементов нет свободных орбиталей.
Повышенная валентность меди, серебра и золота свидетельствует о том, что при образовании химической связи у атомов этих элементов участвуют не только электроны внешнего уровня, но и электроны d-подуровня уровня, соседнего с внешним.
Валентные состояния лантаноидов и актиноидов крайне разнообразны (рис. 11). Наиболее общей валентностью для лантаноидов является валентность, равная трем, хотя для некоторых из них известны двухвалентные соединения, а для церия, празеодима и тербия получены соединения с валентностью, равной четырем. У актиноидов валентность еще более разнообразна и достигает значений 2, 3, 4, 5, 6 и 7 (как отмечалось выше, в СССР получены соединения семивалентных нептуния к плутония), а начиная с 96-го элемента преимущественно проявляется валентность 3 и реже 4; в связи с этим отнесение их к какой-либо группе теряет всякий смысл.
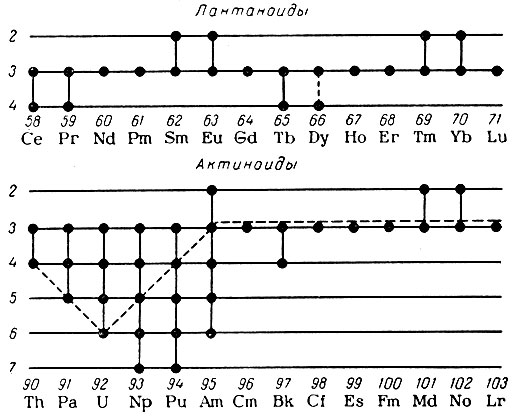
Рис. 11. Возможные валентные состояния лантаноидов и актиноидов (пунктирной линией показано наиболее устойчивое валентное состояние)
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'