
Вторичная периодичность
Еще раньше отмечалось, что по смыслу периодического закона свойства элементов в периодах (слева направо) и в группах (сверху вниз) должны закономерно и линейно изменяться (усиление или ослабление). Вместе с тем было показано (см. рис. 9 и 10), что в пределах каждого периода кривые ионизационных потенциалов, а также радиусов атомов имеют отклонения, обусловленные особенностями построения электронных оболочек атомов. Наиболее существенные отклонения наблюдаются у соединений элементов некоторых групп, а иногда у самих элементов, проявляющих свою максимальную валентность или на две единицы меньше максимальной.
Как установил в 1915 г. русский ученый Е. В. Бирон, в группах:
"...Свойства при последовательном увеличении атомного веса изменяются не последовательно, а периодически. Эту своеобразную периодичность, как бы накладывающуюся на основную периодичность, я предлагаю назвать вторичной периодичностью" (подчеркнуто нами - В. С.).
Вторичная периодичность проявляется как в химических, так и в физических свойствах. Попытка Бирона объяснить вторичную периодичность, вскрыть ее природу не привела к существенным результатам.
Работой Бирона в момент ее появления и в течение последующих 30 лет никто не интересовался. Около 25 лет тому назад профессор Ленинградского университета С. А. Щукарев, вместе со своими сотрудниками начал широкое экспериментальное и теоретическое исследование явления вторичной периодичности. В настоящее время известно более 50 работ советских и зарубежных ученых, подтверждающих закономерность, установленную Бироном.
Рассмотрим изменение теплот образования соединений элементов IVA-группы с кислородом и магнием (рис. 12) и сопоставим их с кривой изменения суммарного потенциала ионизации (I1 + I2 + I3 + I4). Как видно из приведенных данных, теплоты образования (кривые 1 и 3) изменяются не монотонно, а то возрастают, то убывают (через один элемент). Так как кривая 2 меняется также периодически, то, очевидно, вторичная периодичность зависит от структуры электронной оболочки атомов. В случае изменения свойств в группе по закономерности вторичной 7 периодичности нельзя использовать интерполяцию - ошибка здесь неизбежна. Например, теплота образования GeO2 не равна половине суммы теплот образования SiO2 и SnO2.
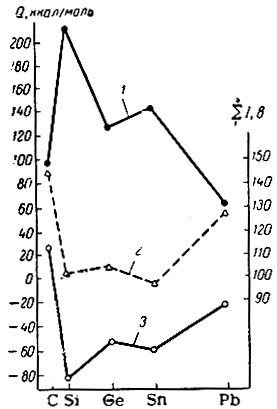
Рис. 12. Теплоты образования (Q) соединений RO2 и Mg2R элементов IVA-группы и их суммарные ионизационные потенциалы (I): 1, 3 - теплоты образования RO2 и Mg2R соответственно; 2 - суммарный ионизационный потенциал
Вторичной периодичностью характеризуется изменение большинства свойств в группе Сu, Ag, Au (свойства серебра не являются средними из свойств меди и золота). Например, температура плавления серебра, равная 960,5° С, не вычисляется как среднеарифметическое из температур плавления меди (1083° С) и золота (1063° С).
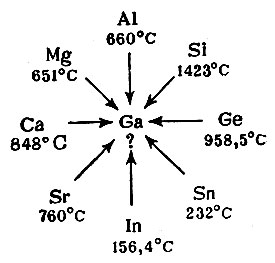
Как известно, при предсказании свойств экаалюминия (галлия), Менделеев отметил, что данный металл должен быть легкоплавким (это было подтверждено экспериментом). Однако если проинтерполировать температуры плавления элементарных веществ, окружающих галлий в периодической системе, по трем возможным направлениям - горизонтальному, вертикальному и диагональному, то его истинная температура плавления (29,78° С) не предугадывается.
Свойства сложных соединений могут изменяться линейно или в соответствии с вторичной периодичностью: это зависит от типа электронов, участвующих в химической связи между взаимодействующими атомами при образовании сложного соединения. Как известно, наиболее общим типом связи между атомами является ковалентная связь. Если у данного атома участвуют в образовании ковалентной связи электроны одного типа, то такие связи называются чистыми (например, связи, осуществляемые р1-, р2- и p3-электронами). Если же связь осуществляется электронами разного типа, то связи называются гибридными (например, sp2, sp3, sp3d2 и др.).
Рассмотрим ряд примеров. Из распределения электронов по орбиталям атомов элементов групп VA, VIA и VIIA (например, азота, кислорода и фтора) следует, что атомы этих элементов и атомы их аналогов осуществляют связь с помощью p3-, р2- и p1-электронов, например в таких соединениях, как NH3, H2O и HF:
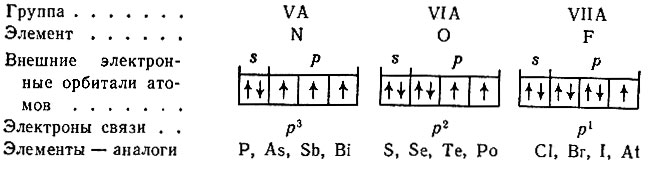
Водородистые соединения неметаллов групп VA, VIA и VIIA, в которых связь осуществляется электронами одного типа, характеризуются линейным изменением свойств, например в ряду HF - НСl - НВr - HI теплоты образования соответственно уменьшаются: 64,4; 21,9; 7,3; 1,32 ккал/моль, а степень термического разложения при 1000° С возрастает и составляет (в %): 0,0; 0,014; 0,5; 33,0, т. е. устойчивость соединений уменьшается.
У атомов элементов групп IIIА и IVA, которым свойственна максимальная положительная валентность 3 и 4, в основном состоянии содержится только один или два непарных электрона. Максимальная валентность может быть достигнута, если за счет внешней энергии один из электронов пары перейдет на свободную орбиталь в р-подуровне. В результате происходит изменение электронной конфигурации s2p1 → s1p2 и s2p2 → s1p3. В возбужденном состоянии у этих атомов имеются соответственно 3 или 4 непарных электрона и, следовательно, атом может осуществлять такое же число ковалентных связей. Однако это электроны разного типа, что должно привести к неравноценности связей в молекуле, например в молекулах ВСl3 и СН4.
Рассмотрим электронные конфигурации атомов бора и углерода в основном и возбужденном состояниях:
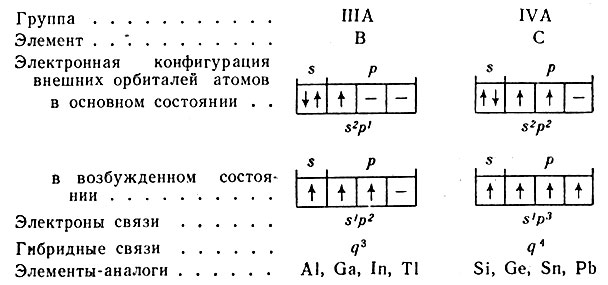
Изучение структур молекул, например, ВСl3 и СН4 показывает, что все связи равноценны, а это означает, что s- и р-электроны занимают некоторый средний, промежуточный, или гибридный подуровень q (рис. 13). Так как энергия всех электронов на гибридном подуровне одинакова, то и связи между В и Сl, С и Н оказываются равноценными.
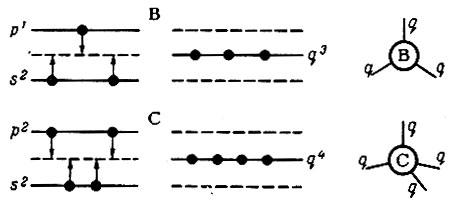
Рис. 13. Гибридные уровни в атомах бора и углерода
При изучении свойств таких соединений, в частности водородных соединений элементов групп IIIА и IVA, в которых атомы проявляют гибридные связи, было показано, что свойства их изменяются в соответствии со вторичной периодичностью. В ряду водородных соединений элементов группы IIIA состав и свойства изменяются через один элемент:
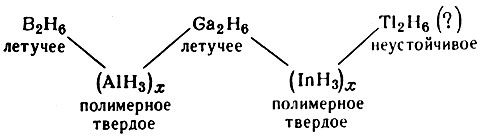
Сравнивая свойства водородных соединений элементов IVA-группы нетрудно установить, что в ряду СН4 (метан), SiH4 (силан), GeH4 (герман) силан окисляется легче, чем метан и герман, и в отличие от них вступает во взаимодействие с водой. Свойства сложных соединений, в которых связи осуществляются возбужденными электронами, изменяются в соответствии с вторичной периодичностью так же, как и свойства соединений, образованных частично поляризованными связями (например, теплоты образования сульфидов, оксидов и галидов). У элементов-аналогов Cl - Вr - I, S - Se - Те, Р - As - Sb теплоты образования окислов средних элементов меньше, чем у окислов крайних элементов. В ряду кислот HNO3, HPO3, HAsO3 фосфорная кислота в отличие от азотной и мышьяковой практически не обладает окислительными свойствами.
Наиболее четко вторичная периодичность проявляется в изменении суммарных ионизационных потенциалов, величины которых зависят от радиусов атомов: чем больше радиус атома, тем меньше величина ионизационного потенциала (см. кривую 2, рис. 12). Это находит объяснение при рассмотрении структуры электронных уровней. Так, повышение ионизационного потенциала у германия связано с относительным сжатием его атома, вызванного заполнением внутреннего уровня десятью d-электронами, в результате чего сила притяжения внешних электронов к ядру возрастает. Относительное сжатие атома наблюдается также у свинца, в котором 4f-подуровень заполнен четырнадцатью электронами; ионизационный потенциал у свинца больше, чем у. олова.
Таким образом, вторичная периодичность связана непосредственно с заполнением в атомах d- и f-подуровней, приводящим к упрочнению связи внешних s- и p-электронов с ядром. Так как первоначальное заполнение d-подуровня наблюдается в атомах элементов четвертого периода, а f-подуровня - в атомах элементов шестого периода, то скачок в изменении свойств должен быть особенно заметен при переходе от элементов третьего периода к четвертому и от элементов пятого периода к элементам шестого периода. В целом вторичная периодичность обусловлена структурой электронных оболочек атомов и в скрытой форме отображается в периодической системе элементов.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'