
Варианты таблиц периодической системы Д. И. Менделеева
Известно свыше 400 вариантов таблиц периодической системы, различающихся размещением отдельных групп элементов-аналогов, способом отображения периодического закона. В некоторых из них группа "инертных" газов размещена в правой части (этими элементами заканчиваются периоды в системе), в других - в левой части (ими начинаются периоды), в третьих - в середине таблицы. Есть таблицы, где элементы располагаются не в порядке заполнения электронных уровней в атомах, а в порядке последовательного расположения в левой части таблицы групп s- и р-элементов, в правой части - всех групп d-элементов, а затем f-элементов. Известны варианты, в которых элементы первого периода расположены внизу таблицы, а над ними элементы последующих периодов, что символизирует постепенное усложнение электронной оболочки атомов. Авторы ряда таблиц делят группы элементов на 3 или 4 подгруппы, внося в эти "дополнительные" подгруппы f-элементы.
Однако большинство этих таблиц, оттеняя периодичность изменения тех или иных свойств элементов и их соединений, ничего принципиально нового не вносят в конструкцию периодической системы. Изменение свойств элементов связано со строением электронной оболочки атома, точнее, с емкостью электронных уровней, равной 8, 18 и 32. Отсюда, естественно вытекает три основных варианта клеточного изображения системы элементов, расположенных в порядке увеличения заряда ядра атома или числа электронов в его оболочке. Таблицы в зависимости от того, какой 8-, 18- или 32-элементный период положен в основу их построения, делятся на 8-, 18- и 32-клеточные.
Тридцатидвухклеточная таблица была нами уже рассмотрена (см. табл. 26) - это длиннопериодная таблица. Выше отмечались преимущества этой естественной формы таблицы. Конечно, эта форма отличается меньшей компактностью, чем другие формы таблицы, но считать это недостатком таблицы нет никаких оснований. Небольшое число ученых относят к недостаткам этой таблицы то, что "якобы" в ней разрывается связь между элементами-аналогами главной и побочной подгруппы. Такое мнение нельзя считать обоснованным, так как с точки зрения строения атома элементы-аналоги должны характеризоваться одинаковым значением конфигурационного индекса, что полностью осуществляется в этом варианте таблицы (исключениями являются конфигурационные индексы лантана и актиния, но это будет подробно обсуждено ниже).
Полудлинная таблица (табл. 33) - восемнадцатиклеточная. В такой таблице 14 f-элементов шестого периода - лантаноиды (занимающие места 58-71) и 14 f-элементов седьмого периода - актиноиды (занимающие места 90-103) помещены в отдельных строках под таблицей. Этим приемом авторы хотят придать таблице более компактную форму и сблизить элементы IIIB- и IVB-групп. Такая таблица как бы представляет собой классификацию s-, р- и d-элементов; f-элементы вынесены из общей таблицы и рассматриваются отдельно (семейства лантаноидов и актиноидов).
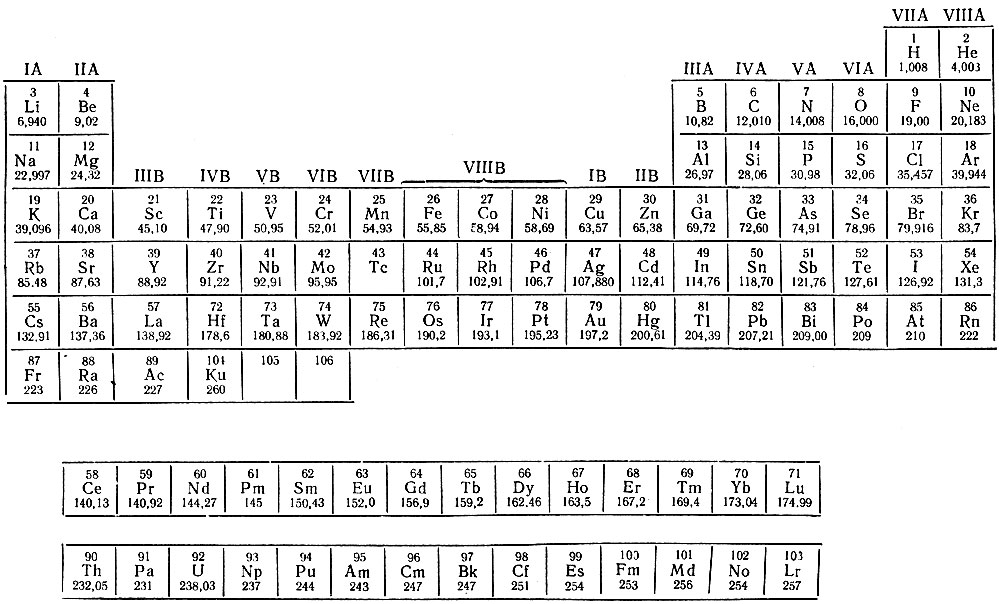
Таблица 33. Полудлинная таблица периодической системы элементов Д. И. Менделеева
В этой таблице имеются два разрыва в расположении элементов по порядковым номерам: после 57-го элемента помещен 72, а после 89-го - 104 элемент. Об указанном разрыве следует всегда помнить, так как он не позволяет логически использовать правило сдвига при рассмотрении процессов радиоактивного распада, приводящих к взаимному переходу ядер атомов от 57 к 58, от 71 к 72, от 89 к 90 и от 103 к 104 или обратно. В химическом аспекте эта таблица неудобна тем, что в ней трудно проследить причину различия свойств элементов с номерами 72-80 от свойств элементов 40-48, расположенных непосредственно друг под другом. При рассмотрении длиннопериодной таблицы (см. табл. 26) эти причины становятся наглядными. Атомы элементов 72-80, стоящие в периодической системе за лантаноидами, испытывают на себе влияние лантаноидного сжатия*, следствием которого является увеличение ионизационных потенциалов, ослабление восстановительных свойств элементов и резкое возрастание плотности элементарных веществ. Этим важным обстоятельством, раскрывающим природу d-элементов, как нам кажется, нельзя пренебрегать в угоду более компактной форме таблицы.
* (Уменьшение радиуса атома за счет усиления притяжения внешних электронов с ростом заряда ядра, происходящее при застройке внутреннего f-подуровня.)
Восьмиклеточная таблица, короткая форма периодической системы чаще всего оформляется в следующих трех вариантах: 1) лантаноиды и актиноиды помещены в нижней части таблицы, все d-элементы внесены в группы s- и р-элементов группы разделены на главную и побочную подгруппы (табл. 34); 2) все элементы распределены по 9 группам, включая нулевую, состоящим из двух подгрупп, кроме VIII- и 0-групп (в последних по одной подгруппе); лантаноиды и актиноиды включены в VI и VII периоды (табл. 35) и 3) все f-элементы помещены внутри системы, семейство лантаноидов разделено на два "подсемейства" по семи элементов в каждом, с некоторым сдвигом клеток в сторону от основных клеток групп элементов; триады железа, рутения и осмия помещены в левой части таблицы без нумерации группы (табл. 36).

Таблица 34. Восьмиклеточная (короткая) таблица периодической системы элементов Д. И. Менделеева
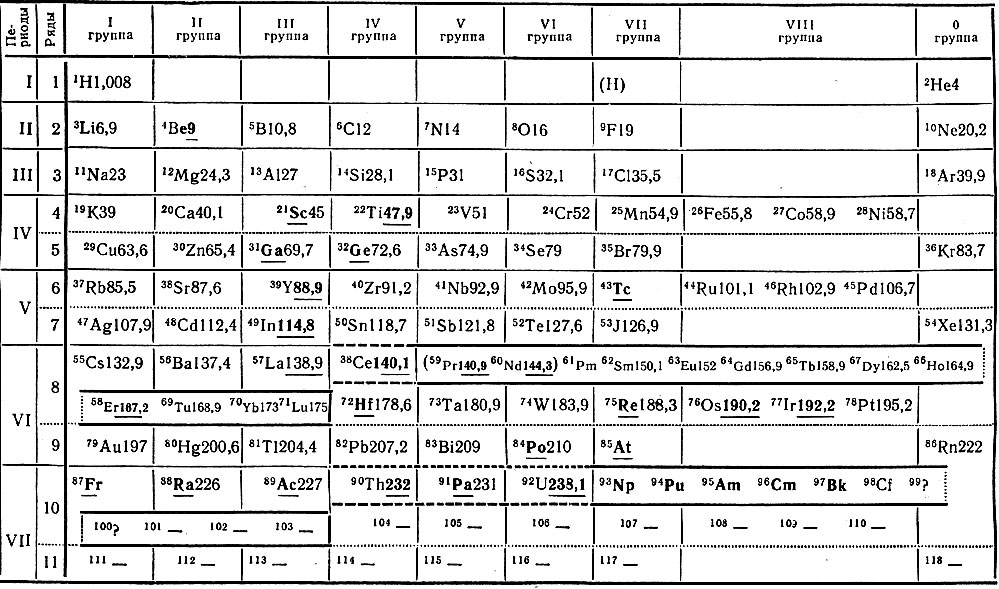
Таблица 35. Девятиклеточная таблица периодической системы элементов Д. И. Менделеева с внесением лантаноидов в VI период и актиноидов в VII период
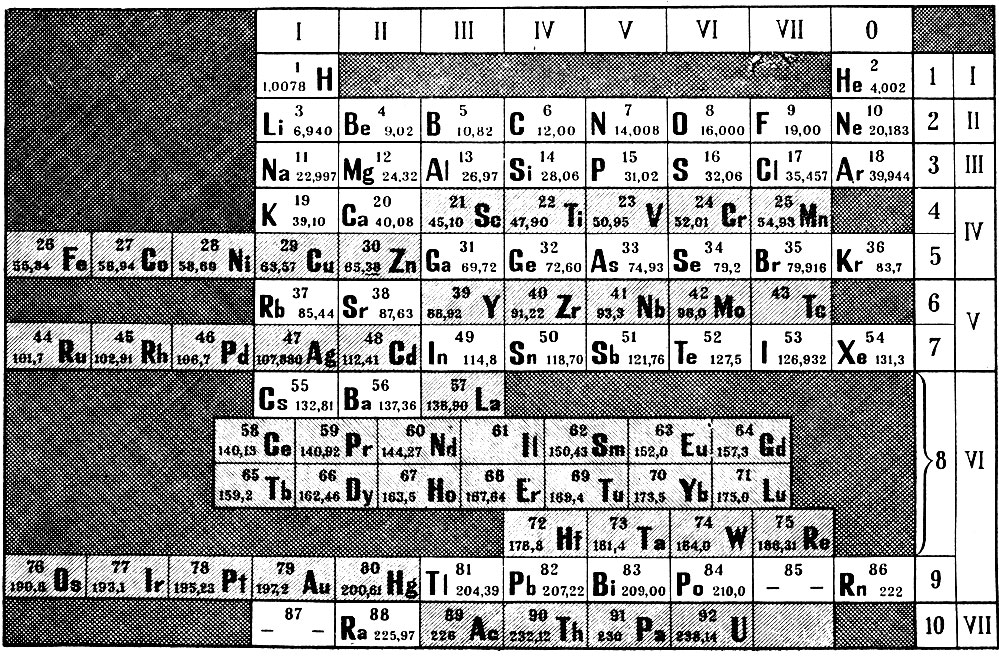
Таблица 36. Короткая таблица периодической системы элементов Д. И. Менделеева с вынесением триад железа, рутения и осмия в отдельную группу без нумерации
Все эти и другие подобные варианты восьмиклеточной таблицы отличаются компактностью, но в них в одни группы попадают s- и p-, s- и d-, p- и d-элементы, атомы которых различаются своей электронной конфигурацией и резко различаются значениями конфигурационных индексов.
Многоцветный вариант таблицы периодической системы элементов Д. И. Менделеева, изданной в виде открытки, издательством "Химия" гораздо более нагляден. В ней s-элементы окрашены в красный цвет, p-элементы - в желтый, d-элементы - в синий и f-элементы - в черный. В I и II группах s-элементы образуют главные или А-подгруппы, d-элементы - побочные или В-подгруппы; в III-VIII периодах главные (А) подгруппы образованы р-элементами, а побочные (В) подгруппы d-элементами; f-элементы (лантаноиды и актиноиды) вынесены вниз таблицы, в отдельные строки. В этом варианте таблицы учтены все ранее рассмотренные доводы в пользу расположения отдельных элементов по группам в соответствии со строением их атомов и свойствами. Так, водород помещен в VIIA-группу (но поставлен в скобках и в группе IA, как бы напоминая о своем некотором сходстве с одновалентными металлами); Fe, Ru и Os размещены в VIIIB-группе, а Со, Ni, Rh, Pd и Ir, Pt выведены из нее; благородные газы помещены в VIIIA-группу и как бы завершают периоды в таблице.
Однако в этой таблице, как вообще во всех восьмиклеточных таблицах, упор делается на аналогию элементов по вертикали - сходство элементов по максимальной валентности, т. е. по свойству, которое, как показано было выше, изменяется далеко не закономерно. Например, достаточно сравнить все свойства и физико-химические характеристики хлора и марганца, чтобы убедиться в резком их различии (единственная аналогия - образование семивалентных соединений). По химической природе марганец более сходен со своими соседями по периоду, т. е. с хромом и железом, чем с хлором, и в этом случае аналогия по горизонтали доминирует над аналогией по вертикали.
В заключение можно сказать, что все три формы системы: длинная, полудлинная и короткая - могут быть использованы для отображения периодического закона. В каждой из форм имеются свои преимущества и недостатки. Однако связь природы элемента со структурой электронной оболочки атомов наиболее полно и однозначно раскрывается длинной формой системы. Изучение периодического изменения свойств элементов на основе электронных структур атомов принесло химической науке невиданное развитие, и не случайно академик Л. В. Писаржевский назвал данный этап в развитии химии электронным этапом.
В настоящее время опубликованы таблицы периодической системы, включающие "гипотетические" восьмой и девятый периоды (Сиборг, Таубе, Гольданский), в которых размещено по 50 элементов, т. е. на 18 элементов больше, чем в шестом и седьмом периодах. Восьмой период начинается элементом с порядковым номером 119 - экафранцием и заканчивается элементом с порядковым номером 168 - двирадоном. Двирадон по своей химической природе должен быть аналогом благородных газов. В девятом периоде первый элемент - двифранций имеет порядковый номер 169, а последний - трирадон, или эка-экарадон - 218. В последних двух периодах должны появиться новые типы элементов, относящиеся к g-элементам, так как у атомов 18-ти элементов каждого периода будет застраиваться g-подуровень (l = 4), максимальная емкость которого равна 18 [Xl = 2 (2·4 + 1) = 18]. Новые 5g-элементы, расположенные в 8-ом периоде, В. И. Гольданский предложил назвать октадеканидами.
Трудно сказать, когда будет осуществлен синтез неизвестных элементов (Z > 105), и вряд ли многие из них будут получены, так как ядра этих элементов крайне неустойчивы, но возможности синтеза 114- и 126-го элементов уже обсуждаются в литературе (см. ниже).
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'