
Металлы, сплавы и интерметаллиды
Несмотря на то что за последние десятилетия в технике получили широкое применение такие неметаллические материалы, как стекло, пластические массы, каучук и резина, все же по-прежнему основными конструкционными материалами являются металлы и их сплавы.
В соответствии со строением атома к металлам относят элементы s- (кроме Н и Не), d- и f-типов, а из элементов p-типа - алюминий, галлий, индий и таллий. В химическом отношении металлы являются только восстановителями и не образуют с водородом при нормальных условиях газообразных соединений. Общеизвестно также, что металлы обладают относительно высокой тепло- и электропроводностью. По этим свойствам к металлам относят такие элементарные вещества, как олово, свинец и висмут, отличающиеся от типичных металлов своей способностью образовывать с водородом газообразные соединения, а в реакциях наряду с восстановительными свойствами проявлять и окислительные. Таким образом, металлами можно считать более 4/5 всех элементов.
Одна из таблиц (табл. 37), в которой проводится разделение элементов на металлы и неметаллы, была предложена в 1947 г. Н. В. Агеевым - известным специалистом в области физики и химии металлов и сплавов. В этой таблице показана кристаллическая структура элементарных веществ, имеющая важное значение при изучении сплавов.
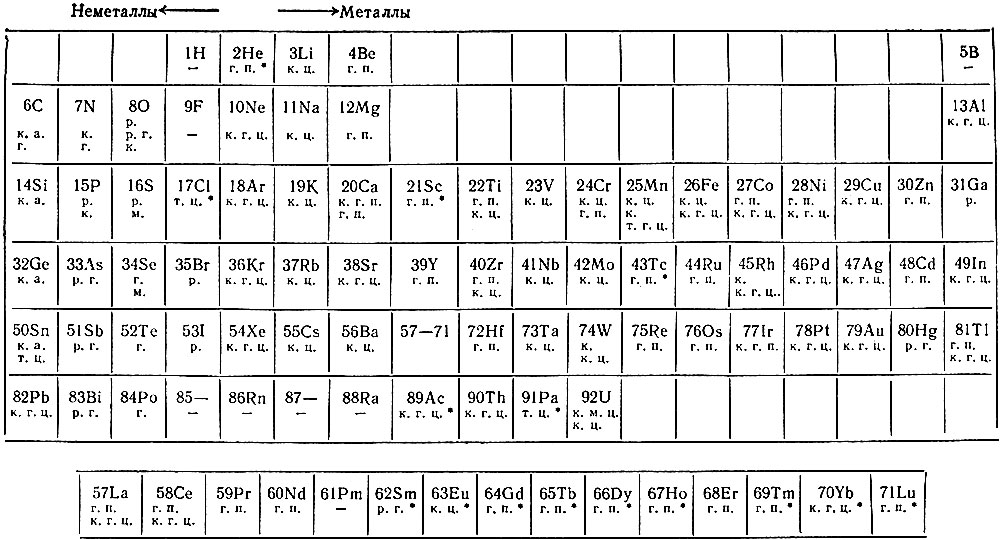
Таблица 37. Таблица элементов и их кристаллическая структура
Примечания. 1. Кристаллическая структура: к. - кубическая, к. ц. - кубическая центрированная, к. г. ц. - кубическая гранецентрированная, к. а. - кубическая алмазная, г. - гексагональная, г. п. - гексагональная плотная, т. ц. - тетрагональная центрированная, т. г. ц. - тетрагональная гранецентрированная, р. г. - ромбоэндрическая, р. - ромбическая, м. - моноклинная. 2. Данные, отмеченные в таблице *, приводятся нами (В. С.).
Для многих металлов характерно явление сверхпроводимости, заключающееся в том, что при очень низких температурах металлы не оказывают заметного сопротивления прохождению электрического тока. Явление сверхпроводимости наблюдали при температурах ниже 10 °К (-263 °С). Известны 24 металла, обладающие сверхпроводимостью при температуре от 0,3 °К (гафний) до 9,22 °К (ниобий). В табл. 38 показана связь сверхпроводимости металлических элементов с их положением в периодической системе.
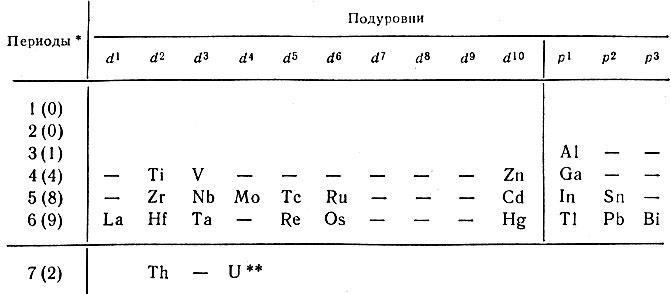
Таблица 38. Сверхпроводимость металлических элементов
* (В круглых скобках указано число сверхпроводников в периодах.)
** (Подуровни атомов Th и U - f2 (?) и f3.)
Из таблицы видно, что большинство сверхпроводников относятся к d-элементам- 15, к p-элементам относится 7 и к f-элементам - только 2, среди s-элементов сверхпроводников не обнаружено*. По сверхпроводниковым свойствам Sn, Pb и Bi также можно отнести к металлам. Из таблицы видно также, что с увеличением номера периода увеличивается и число элементов со сверхпроводниковыми свойствами. Можно считать, что увеличение числа электронных уровней в атоме благоприятствует проявлению сверхпроводниковых свойств. По-видимому, в недалеком будущем должны быть обнаружены новые сверхпроводники среди металлов 7-го периода, а также у лантаноидов - элементов 6-го периода.
* (При высоком давлении (55 тыс. атм) обнаружены сверхпроводниковые свойства у бария (при температуре около 1,3 °К).)
Не обнаружены сверхпроводники среди элементов, атомы которых имеют в электронной оболочке 7, 8, 9d-электронов и свыше трех p-электронов во внешнем уровне. Интересно, что медь, серебро и золото, проявляющие в обычных условиях среди металлов максимальную электропроводность, не обладают сверхпроводимостью. По-видимому, сверхпроводимость мало зависит от внешних электронов и обусловлена наличием свободных орбиталей на d-, p- и f-подуровнях. Какой-либо закономерной связи между температурой перехода в сверхпроводящее состояние и положением элементов в периодической системе пока не установлено.

Николай Семенович Курнаков (1860-1941)
Систематические исследования взаимодействия между металлами - элементами, мало различающимися своими химическими свойствами, стали проводиться со времени введения в практику методов физико-химического анализа, в основе которых лежит исследование изменения свойств системы с изменением ее состава. Основополагающие теоретические и экспериментальные работы в этой области принадлежат Н. С. Курнакову; он же ввел сам термин "физико-химический анализ". Наиболее простым объектом изучения являются двухкомпонентные системы, состоящие из двух различных металлов. Добавляя к одному металлу переменные количества другого металла, т. е. изменяя количественный состав системы, изучают изменение какого-либо физического свойства, например электропроводности, твердости, температуры плавления или кристаллизации, плотности, вязкости. На основании полученных данных строят диаграмму "состав - свойство" и по виду диаграммы делают заключение о типе взаимодействия между металлами.
В настоящее время изучено несколько тысяч диаграмм "состав - свойство" двухкомпонентных систем; на основе полученных данных сделаны следующие выводы.
1. Два металла могут образовать химическое соединение, называемое интерметаллидом. Например, титан с алюминием образует интерметаллид состава Ti3Al, а магний с кадмием - три интерметаллида: Mg3Cd, MgCd и MgCd3.
2. Два металла могут давать непрерывные твердые растворы, т. е. неограниченно растворяться друг в друге при любых количественных соотношениях. Твердые растворы обладают единой кристаллической решеткой, в узлах которой содержатся атомы (ионы) обоих металлов; соотношение между числом атомов в решетке будет таким же, как и в исходном расплаве. Например, если в начальном расплаве содержалось по 50 атомн. % меди и золота (соотношение между числом атомов 50:50 = 1:1), то в кристаллической решетке на один атом меди будет приходиться один атом золота.
3. Два металла могут давать ограниченные твердые растворы. Примером может служить система из хрома и иттрия: в интервале температур от 1100 до 1300 °С в иттрии растворяется 2 атомн. % хрома, а в последнем 1 атомн. % иттрия.
4. Два металла могут образовать эвтектический сплав, т. е. смесь мельчайших кристалликов обоих металлов, каждый из которых имеет самостоятельную кристаллическую решетку. Эвтектические смеси плавятся при более низких температурах, чем чистые металлы. Например, эвтектический сплав, состоящий из 24,4 атомн. % свинца (т. пл. 327 °С) и 75,6 атомн. % олова (т. пл. 232 °С), плавится при 181 °С.
5. Два компонента не взаимодействуют друг с другом. В расплавленном состоянии металлический галлий не смешивается с жидким свинцом (подобно смеси вазелинового масла с водой).
Число возможных двухкомпонентных систем, вероятно, будет равно числу сочетаний из 75 (число известных металлов) по два, т. е. оно чрезвычайно велико. Вполне естественно, что многие из возможных систем еще остаются неизученными. Взаимодействие какого-нибудь одного металла с другими можно проследить на примере серебра, (табл. 39), воспользовавшись данными И. И. Корнилова* для 79 элементов (кроме лантаноидов и элементов с Z = 95 ÷ 105).
* (И. И. Корнилов, Н. М. Матвеева, Л. И. Пряхина, Р. С. Полякова, Металлохимические свойства элементов периодической системы, Изд. "Наука", 1966, стр. 272.)
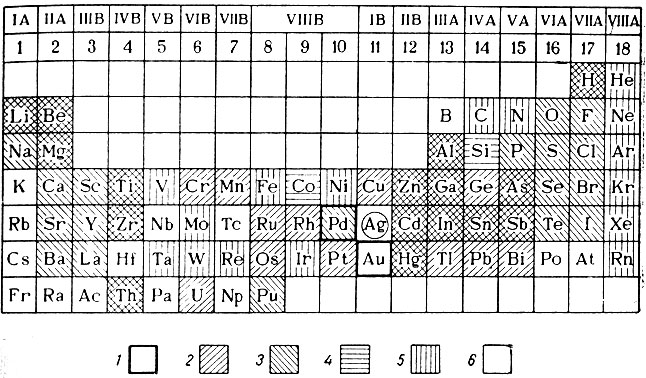
Таблица 39. Взаимодействие серебра с другими элементами периодической системы
1 - элементы, образующие непрерывные твердые растворы; 2 - элементы, образующие ограниченные твердые растворы; 3 - элементы, образующие соединения; 4 - элементы, образующие эвтектические сплавы; 5 - элементы невзаимодействующие; 6 - неизученные элементы.
Из приведенной таблицы следует, что только золото (Аu) и палладий (Pd) образуют с серебром непрерывные твердые растворы (для Pd характерно также образование интерметаллидов); 28 элементов с серебром дают ограниченные твердые растворы, а 16 из них одновременно - интерметаллиды (клетки с диагональной двойной штриховкой); 17 элементов характеризуются образованием с серебром интерметаллидов; для двух элементов - кобальта (Со) и кремния (Si) установлены эвтектические сплавы; 16 элементов не взаимодействуют с серебром, а системы серебра и 13 различных металлов до сих пор не изучены.
Различное отношение к серебру рассматриваемых элементов обусловливается рядом причин: химической природой элемента (а следовательно, структурой электронной оболочки атома и положением в периодической системе Д. И. Менделеева); соотношением между радиусами атомов обоих компонентов; значениями ионизационных потенциалов, сродства к электрону и электроотрицательностей; типом и размерами кристаллических решеток компонентов системы и др. Одним из важных факторов является природа химической связи, возникающей между компонентами системы.
Чем дальше друг от друга в периодической системе отстоят элементы, тем больше они отличаются друг от друга химической природой, радиусами атомов, числом валентных электронов, величинами ионизационных потенциалов и электроотрицательностей, тем энергичнее они соединяются, образуя ионные молекулы. Чем ближе расположены элементы друг к другу в периодической системе, тем менее возможно образование соединений с ионной связью и тем вероятнее возникновение ковалентной связи, осуществляемой общими парами электронов, или металлической связи, при которой положительные ионы удерживаются в узлах кристаллической решетки вследствие взаимодействия с "коллективом" валентных электронов, равномерно распределенных в объеме решетки. Естественно, что металлическая связь проявляется между элементами, расположенными в металлической области периодической системы (см. табл. 37). Этот тип связи доминирует при образовании твердых растворов.
Если сравнивать соединения одного и того же металла с элементами какой-либо одной группы, например Mg с элементами группы IVA:
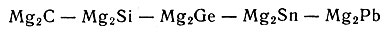
то можно проследить, как ковалентный тип связи уступает образованию металлической связи, явно превалирующей в соединении Mg2Pb. Это объясняется тем, что по мере перехода от С к Рb усиливаются металлические свойства, которые наиболее выражены у Рb.
На примере систем серебра с металлами, расположенными в разных группах, можно установить причины образования систем металл - металл разного типа. Для этого следует сравнить характеристики металлов (табл. 40).
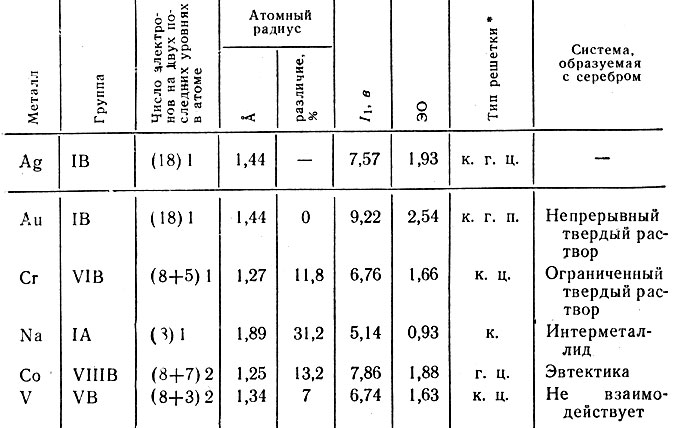
Таблица 40. Атомные характеристики и тип кристаллической решетки систем серебро - металл
* (Обозначения типа решетки см. в табл. 37.)
Так, характеристики Na и Ag наиболее сильно различаются, этим и объясняется образование интерметаллида. Образование непрерывного твердого раствора серебром и золотом обосновывается положением элементов в одной группе периодической системы, одинаковой структурой двух последних уровней в оболочке атомов и аналогичным типом кристаллической решетки. Различие структур электронных уровней, величин радиусов и кристаллических решеток кобальта и серебра является объяснением образования эвтектической смеси.
На основе анализа большого числа систем различных элементов можно сделать выводы об условиях образования систем того или иного типа.
1. Оптимальными условиями образования непрерывных твердых растворов между двумя элементами являются: нахождение элементов в одной группе периодической системы, одинаковый тип решетки, лишь незначительное различие размеров атомных радиусов (не более 10%), близость величин ионизационных потенциалов и электроотрицательностей.
2. Если радиусы атомов различаются на 10-20%, что, естественно, приводит к большому различию в ионизационных потенциалах и электроотрицательностях, то происходит образование ограниченных твердых растворов или интерметаллидов.
3. При различии радиусов атомов более чем на 20% элементы, как правило, не взаимодействуют друг с другом и нередко не смешиваются в расплавленном состоянии.
Пользуясь сведениями о свойствах элементов, можно предугадать возможность того или иного взаимодействия между металлами. Из табл. 39 видно, что до сих пор не изучены системы серебра с калием, рубидием и цезием. Если сопоставить радиусы атомов серебра и указанных элементов и вычислить их различие (в %): Ag - 1,44 A; К - 2,36 А (64%); Rb - 2,48 A (72%); Cs - 2,68 A (86%) можно прийти к заключению, что взаимодействие между ними невозможно.
Теперь становится теоретически объяснимым эмпирическое правило Таммана:
Элементы одной и той же группы металлов не образуют между собой химических соединений; если какой-нибудь элемент дает химическое соединение с одним из элементов какой-либо группы, то он вступает в соединения со всеми остальными элементами данной группы.
На основе выявленных общих закономерностей стал возможен научный подход к проблеме получения сплавов с заданными свойствами, а следовательно, стало возможным предотвращение ошибок в этой важной отрасли промышленности. Основной "диспетчерской" картой металлохимиков является периодическая система Д. И. Менделеева.
Изменения магнитных свойств элементарных веществ, в том числе и металлов, также тесно связаны со структурой электронной оболочки атомов и, следовательно, с положением элементов в периодической системе Менделеева. Действительно, магнитная восприимчивость элементов (χ) изменяется с увеличением порядкового номера (рис. 14).
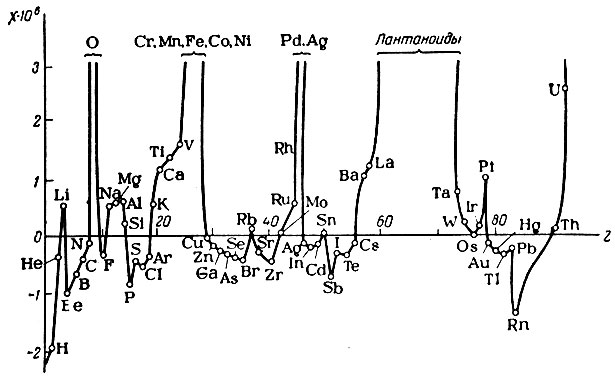
Рис. 14. Магнитная восприимчивость (χ) химических элементов
Все вещества по способности взаимодействовать с внешним магнитным полем подразделяются на диамагнитные, парамагнитные и ферромагнитные.
Диамагнитными веществами называются такие, атомы или молекулы которых не обладают собственным магнитным моментом, но под влиянием внешнего поля приобретают намагниченность, ориентированную противоположно направлению внешнего поля. Парамагнитными являются вещества, атомы или молекулы которых обладают собственным магнитным моментом, но вещество в целом в отсутствие магнитного поля не намагничено, так как вследствие хаотичности расположения частиц их результирующий момент равен нулю. У такого вещества в магнитном поле происходит преимущественная ориентация частиц параллельно направлению поля. Ферромагнитными веществами называются такие, атомы или молекулы которых обладают собственным магнитным моментом в отсутствие внешнего магнитного поля, причем магнитные моменты отдельных частиц имеют одинаковое направление, или ориентацию.
Намагниченность, вызванная внешним полем, пропорциональна его напряженности, а коэффициент пропорциональности, называемый магнитной восприимчивостью, является характеристикой данного вещества. Для диамагнитных веществ она имеет отрицательный знак, для других - положительный (см. рис. 14).
Следует отметить, что магнитный момент атома в целом определяется суммарным магнитным моментом протонов, нейтронов и электронов. Так как собственные магнитные моменты протона и нейтрона примерно в тысячу раз меньше магнитного момента электрона, то магнитный момент атома определяется в основном суммарным значением магнитного момента электронов.
Анализ всех количественных данных по магнитной восприимчивости позволяет сделать некоторые выводы.
У атомов с замкнутой электронной структурой, т. е. не имеющих непарных электронов, магнитные моменты равны нулю; соответствующие вещества являются диамагнетиками. Во всех группах периодической системы диамагнетизм возрастает с увеличением порядкового номера элементов, особенно у тех из них, в чьих атомах заполнены электронами внутренние уровни (элементы больших периодов).
В атомах элементов d-типа, с недостроенными d-подуровнями, проявляется пара- или ферромагнетизм. Например, в четвертом периоде от калия к никелю возрастает парамагнетизм, а последние три элемента - железо, кобальт и никель - ферромагнитны.
Лантаноиды обнаруживают достаточно резко выраженный парамагнетизм, так как в их атомах застраивается глубинный 4f-подуровень (по-видимому, такими свойствами обладают и актиноиды, но о них нет еще достаточно полных данных).
Магнитные свойства характерны не только для нейтральных атомов, но и для ионов и молекул; изучение этих свойств позволяет выявить детали строения частиц, а следовательно, и другие свойства.
Природа отдельного металла в конечном счете определяется зарядом ядра атома и структурой его электронной оболочки. Рассмотреть закономерное изменение всех свойств металлов в значительной мере помогает периодическая система элементов Менделеева. Так, при использовании таблицы Менделеева удается проследить изменение с увеличением атомного номера металла сверхпроводимости его, магнитных свойств, плотности, температур плавления и кипения, электропроводности, теплопроводности, твердости, изменение взаимодействий в системе "металл - металл" и др.
Комплексные услуги металлообработки в Москве.
|
ПОИСК:
|
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'