
Простые и комплексные соединения
Элементарной частицей вещества является молекула. Молекула простого вещества может состоять из одного атома (Не, Хе, Rn) или нескольких атомов одного элемента (Н2, O2, Р4, I2, S8, S6 и др.). Молекула сложного вещества состоит из двух и более атомов различных элементов (СO2, СН4, BaO, SiO2, NaCl, KI, SF6 и др.). Разные вещества могут различаться не только качественным составом молекул, но и количественным ее составом. Так, известны вещества, молекулы которых состоят из различного числа одинаковых атомов, например O2 (кислород) и О3 (озон). Это разные вещества с разными свойствами.
Встречаются вещества, молекулы которых состоят из атомов одних и тех же элементов, взятых в одинаковом количестве, но все же сильно различающиеся по свойствам. Формуле С3Н6O соответствуют два вещества - уксусный альдегид (I) и ацетон (II)
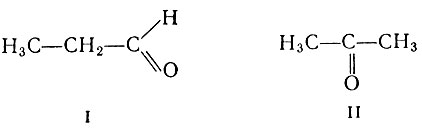
Атомы в их молекулах по-разному расположены относительно друг друга, т. е. молекулы имеют неодинаковое строение, и вещества обладают совершенно разными свойствами. Существуют вещества, молекулы которых включат одинаковое число атомов одних и тех же элементов, причем порядок соединения атомов друг с другом одинаков, но в пространстве отдельные группы атомов расположены по-разному. Такие вещества также обладают разными свойствами. Наконец, одно и то же вещество может иметь несколько кристаллических модификаций (например, алмаз, графит и карбин), различающихся некоторыми свойствами.
Пространственное строение молекул изучает наука, называемая стереохимией, кристаллическое строение вещества - кристаллохимия. Для исследования строения молекул и кристаллов широко используются методы рентгенографии и электронографии.
Пространственное строение молекул зависит от природы химической связи, возникающей между атомами, а следовательно, структуры их электронной оболочки. Так как в химической связи могут участвовать электроны s-, p-, d- и f-типа от каждого из взаимодействующих атомов, то в зависимости от типа и числа электронов, а также от возможности образования гибридных связей зависит строение молекул.
Молекулы состава АА и АВ, состоящие из двух атомов одинаковых или различных элементов, независимо от типа взаимодействующих электронов s1-s1, р1-р1, s1-р1 и др. имеют всегда линейную форму, т. е. центры атомов лежат на прямой линии. Например, Н-Н, Cl-Сl, Н-Cl, Na-F, К-Вr и др. Такие молекулы характерны для элементов IA- и VIIA-групп.
Если в молекуле состава АВ2 атом А элемента IIА-группы имеет в возбужденном состоянии два электрона разного типа s1p1, то в результате гибридизации образуются две равноценные связи (гибридизованное состояние электронов - q2), которыми атом А соединяется с двумя атомами В. Молекула состава АВ2 будет иметь линейную форму В-А-В с углом между связями 180°. В качестве примера можно назвать молекулы следующих веществ: BeF2, MgCl2, CaH2.
Молекулы состава АВ3, в которых атом А - атом элемента IIIA-группы в возбужденном состоянии имеет электронную конфигурацию s1p2 (или в результате гибридизации - q3), обладают формой равностороннего треугольника. В центре его расположен атом А, а в вершинах - атомы В; углы между связями составляют 120°. Например, такими веществами будут ВСl3, АlВr3, BF3.
Если в молекуле АВ4 атом А является атомом элемента IVA-группы с электронной конфигурацией в возбужденном состоянии s1p3, то в результате гибридизации электронов образуются четыре равноценных гибридных подуровня q4. Такая молекула имеет тетраэдрическую форму, в центре тетраэдра находится атом А, а под углом 109° 28' располагаются четыре связи, направленные к вершинам тетраэдра, с находящимися в них атомами В. В качестве примера можно указать соединения: СН4, CF4, ССl4, SiH4, SiCl4, GeCl4.
Молекулы состава А3В, в которых В-атом элемента VA-группы, участвует в образовании химической связи p3-электронами одного типа, имеют форму пирамиды, в вершине которой находится атом В, а три атома А расположены в углах треугольного основания. Углы между связями колеблются от 91° 20' до 109°. К таким соединениям относятся NH3, PH3, PCl3, BiCl3, AsH3, PI3 и др.
Молекулы состава А2В, в которых В-атом элемента VIA-группы, участвует в образовании химической связи своими p2-электронами, характеризуются угловой формой*: угол связи меняется от 90 до 105°, иногда имеет и большие значения, но меньше чем 180°. К угловым молекулам можно отнести: Н2O, H2S, H2Se, H2Te.
* (По современным квантовомеханическим представлениям, электронам каждого типа отвечает электронное облако определенной формы: s-электронное облако имеет сферическую форму, р-облако - вид гантели, d- и f-облака - более сложную форму (четырех или шестилопастную). Два p-электронных облака располагаются перпендикулярно друг к другу в направлении координат плоскости, чем и обусловливается угловая структура молекул.)
Таким образом, элементы разных групп периодической системы, обладая разными электронами связи, способны к образованию молекул разного типа. Например:

При усложненном процессе гибридизации, когда в химической связи участвуют не только s- и p-электроны, но d- и f-электроны, образуются молекулы более сложной формы.
Рассмотрим процесс образования молекулы SF6. Атом серы в основном состоянии имеет электронную конфигурацию 3s23p4:
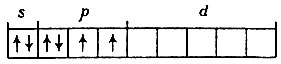
Из шести электронов, находящихся на третьем уровне, только два непарные, они и определяют валентность -2. Для того чтобы повысить валентность серы до шести, необходимо два электрона перевести на свободные орбитали d-подуровня:
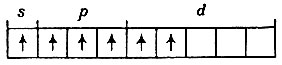
Электронная конфигурация атома серы в возбужденном состоянии будет s1p3d2. При образовании химической связи произойдет гибридизация, в результате которой электроны связи перейдут в состояние, соответствующее гибридным подуровням q6. В этом случае молекула SF6 должна иметь октаэдрическую форму: в центре октаэдра находится атом серы, а в шести его углах - по одному атому фтора (рис. 15).
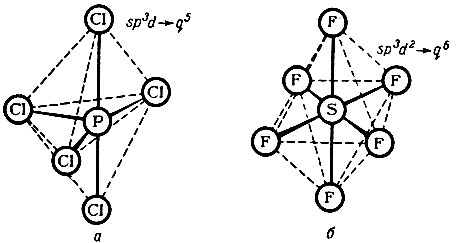
Рис. 15. Структуры молекул (РСl5 и SF6) при гибридных связях
На том же рисунке показана другая форма (тригональная: бипирамида) молекулы РСl5, отвечающая иному типу гибридизации sp3d. Конечно, указанными формами не исчерпывается большое разнообразие возможных форм молекул различных соединений.
Несмотря на то, что механизм образования связи один и тот же, возникающие молекулы можно отнести к трем основным типам: неполярные, полярные и ионные. Напомним, что для неполярных молекул характерна ковалентная связь, которая образуется общей парой электронов, занимающей симметричное положение между двумя атомами; если эта общая пара смещается, из симметричного положения к более электроотрицательному атому, то возникает полярная молекула, или диполь. Наконец, при сильном смещении общей пары к электроотрицательному атому (это равносильно переходу электрона одного из атомов в сферу другого) возникает ионная молекула.
Естественно, что молекулы простых веществ (Н2, N2, Сl2, O2 и др.) являются неполярными. Чем дальше в периоде отстоят элементы друг от друга, тем больше они отличаются значениями электроотрицательностей и тем резче выражен ионный тип связи у молекулы, образованной атомами данных элементов (MgO, CaO, LiF, NaCl, KBr). Обычно симметрично построенная молекула, в центре которой находится атом элемента в состоянии высокой валентности, является неполярной (ССl4, SiF4 и др.).
Таким образом, способность элемента к образованию молекул различных веществ, характер возникающих связей, вид и строение изолированной молекулы - все это находится в тесной связи со строением атома и, главным образом, с конфигурацией внешней электронной оболочки его, т. е. с положением элемента в периодической системе элементов. Можно установить определенные аналогии в этих характеристиках элементов одной группы. Однако на практике приходится иметь дело не с отдельной изолированной молекулой, а с большим числом их, с веществом в целом. Естественно возникает вопрос о взаимодействии молекул и относительной "силе" этого взаимодействия. Силы, обусловливающие взаимодействие молекул, называются межмолекулярными. Они определяются не только строением молекул, но и агрегатным состоянием вещества, так как при изменении последнего изменяется и расстояние между молекулами, а следовательно, и силы взаимодействия между ними: в газообразном состоянии в веществе действуют наименьшие межмолекулярные силы, а в твердом - наибольшие. При этом аналогии, характерные для молекул, могут и не проявляться у данных веществ, что можно проследить на примере двух соединений СO2 и SiO2. Углерод и кремний элементы - аналоги IVA-группы, расположенные соответственно во 2-м и 3-м периодах. В возбужденном состоянии атомы этих элементов характеризуются электронными конфигурациями 2s1p3 и 3s1p3, т. е. имеют по четыре непарных электрона и могут осуществлять по четыре ковалентные связи; в атоме углерода нет свободных орбиталей, а в атоме кремния имеются свободные 3d-орбитали.
В обычных условиях двуокись углерода - газообразное вещество. Между непарными электронами атома углерода и двумя атомами кислорода возникают четыре ковалентные связи. Молекула СO2 обладает линейным строением O = С = O; расстояние между атомами углерода и кислорода равно 1,13 А. Это - типичная неполярная молекула. При -56,6 °С и давлении 5,28 атм Двуокись углерода сосуществует в трех агрегатных состояниях: газообразном, жидком и твердом. В твердом состоянии СO2 характеризуется молекулярной кристаллической решеткой, т. е. в узлах решетки находятся молекулы СO2 с теми же ковалентными связями, но с несколько меньшим расстоянием С-О, равным 1,05 А.
Структурный тип молекулы СO2 при изменении агрегатного состояния практически не изменяется; число связей отвечает валентности элементов. Аналогичными свойствами будут обладать и другие вещества с типично ковалентными связями неполярного характера с неизменяющимся структурным типом молекулы в различных агрегатных состояниях (например, СН4, AsH3, SiF4, NF3 и др.).
Казалось бы, сказанное о двуокиси углерода можно целиком отнести и к молекуле двуокиси кремния. В действительности наблюдается другое. В обычных условиях изолированных молекул SiO2 не известно, а существует одна гигантская молекула (SiO2)n, в которой каждый из 2n атомов кислорода связан с двумя атомами кремния, а каждый атом кремния связан с четырьмя атомами кислорода:
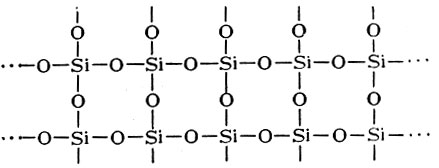
В целом образуется трехмерный каркас с повторяющимися звеньями. Процесс перехода n SiO2 в (SiO2)n называется полимеризацией. Следовательно, двуокись кремния является неорганическим полимером. Для полимерных соединений такого типа характерны высокая температура плавления, относительно большая плотность и твердость. Двуокись кремния плавится лишь при 1723° С.
В отличие от двуокиси углерода при образовании двуокиси кремния, помимо ковалентных связей, между непарными электронами кремния и кислорода возникают "дополнительные" химические связи за счет свободных 3d-орбиталей атомов кремния и неподеленных пар электронов атомов кислорода.
С усложнением строения атома, начиная с третьего периода, появляются новые подуровни, увеличивается число свободных орбиталей и возрастает число связей между атомами, возрастает и возможность образования сложных молекул. К числу сложных по составу молекул относятся соединения, названные комплексными.
При возникновении комплексного соединения один из компонентов предоставляет неподеленную пару электронов - донору, а другой - акцептор "пустую", или свободную орбиталь, в результате чего осуществляется их взаимодействие. Такой тип связи получил название донорно-акцепторной или координативной. Как акцептором, так и донором электронов при образовании комплексных соединений могут быть атомы, ионы и молекулы. Наиболее распространенными являются соединения, в которых акцептором служит положительный ион металла или атом определенной степени окисления. Такой акцептор принято называть комплексообразователем. Вокруг него координируются нейтральные молекулы или отрицательно заряженные ионы, являющиеся донорами пар электронов и называемые лигандами. Максимальное число лигандов определяется числом представляемых комплексообразователем свободных орбиталей. Число лигандов, окружающих центральный ион, называется координационным числом.
Практически все элементы могут играть роль комплексообразователя. Однако наибольшее число комплексных соединений известно для d-элементов 4-, 5- и 6-го периодов системы. В качестве примера того, что и элементы 2-го периода способны быть комплексообразователем (лишь бы они могли стать акцепторами пар электронов), можно рассмотреть образование комплексного соединения лития. Атом лития имеет электронную конфигурацию 1s22s12p0 и при образовании иона Li+ теряет один электрон. Следовательно, все четыре орбитали внешнего электронного уровня (2sp3) иона лития свободны:
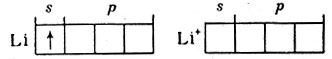
Таким образом, ион Li+ может быть акцептором четырех пар электронов, т. е. вокруг него может скоординироваться четыре частицы, являющиеся донорами электронных пар. В качестве донора могут, например, быть молекулы аммиака, в которых три атома водорода присоединены ковалентными связями к атому азота, но у последнего имеется неподеленная пара электронов. Процесс можно представить так:
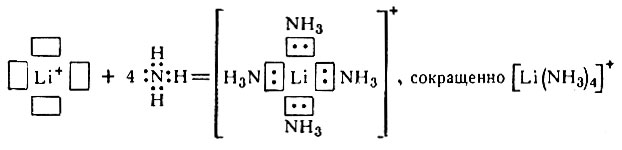
Образовавшийся комплексный положительный ион может сочетаться с любым отрицательным ионом (Х-), в результате чего получится нейтральная молекула [Li(NH3)4]X. В этом соединении комплексообразователем является Li+, а лигандами - молекулы NH3.
Комплексообразователь вместе с лигандами образует комплексную частицу, которая может нести положительный заряд (как в разобранном примере), отрицательный заряд или быть нейтральной. Заряд частицы определяется зарядом комплексов образователя и лигандов: если лигандами служат отрицательные ионы, суммарный заряд которых превышает положительный заряд центрального иона, то общий заряд комплексной частицы будет отрицательный, если суммарный заряд лигандов равен заряду центрального иона, то комплексная частица - нейтральна. В первом случае, примером которого является рассмотренное соединение лития, комплексная группа служит катионом, во втором - анионом и в третьем она является молекулой.
В зависимости от заряда комплексной группы комплексные соединения делят на три типа: положительные, отрицательные и нейтральные, например:
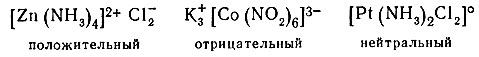
Комплексообразователь вместе с лигандами образуют так называемую внутреннюю сферу комплекса, ее принято заключать при написании формулы в квадратные скобки, а заряд частицы указывать за скобкой, относя его ко всей частице. Ионы, нейтрализующие заряд комплексной частицы, образуют внешнюю сферу. Естественно, если комплексная частица нейтральна, внешней сферы нет. В этом случае вся формула, описывающая состав комплексной частицы, заключается в квадратные скобки.
Внутренняя сфера состоит из центрального атома, или иона-комплексообразователя, и координирующихся вокруг него полярных молекул или отрицательных ионов, называемых лигандами. Как правило, центральными атомами могут быть положительные ионы пли атомы с положительной степенью окисления, например: Fe2+, Fe3+, Co3+, Ni2+, Cr3+, Ag+, Au+, Hg2+, Cd2+, Pt2+, B3+, Si4+ и др. Лигандами могут быть полярные молекулы: NH3, Н2O, NO, СО, РН3, N2H4 и др. и отрицательные ионы: Сl-, F-, OH-, NO2-, Br-, I-, CN-, СО32-, SO42- и др.
Ввиду того что число свободных орбиталей атома комплексообразователя может быть самым разным, координационное число теоретически может принимать значение от 1 до (по крайней мере) 16. Однако число координируемых лигандов ограничивается не только числом предоставляемых орбиталей, но и размерами центрального иона (или атома) и самого лиганда. Известны комплексы с числом лигандов от 1 до 12, но наиболее распространены комплексные соединения, в которых координационное число центрального атома равно 2, 3, 4 и 6. Так как значение координационного числа зависит от размера и строения центрального атома, то, следовательно, способность к образованию комплекса и его вид определяются положением элемента в периодической системе.
Выше было отмечено, что атомы или ионы элементов второго периода могут иметь предельное координационное число, равное 4, так как в химическую связь могут вовлекаться максимально 4 орбитали. У атомов или ионов элементов третьего периода в осуществлении координативной связи помимо одной s- и трех р-орбиталей могут вовлекаться еще две d-орбитали, а потому предельное максимальное координационное число может быть 6. Это подтверждается составом комплексных ионов элементов третьего периода: [Mg(H2O)6]2+, [Al(OH)6]3-, [SiF6]2- и т. п.
У атомов и ионов элементов последующих периодов (4-7) координационное число 6 может сохраняться, но может и возрастать до 7, например у K2[TaF7], до 8, например у Na4[W(CN)8], и до 9, например у [Nd(H2O)9]Cl3, если в координативную связь вовлекаются, соответственно, три, четыре и пять d-орбиталей. Если же в образовании координативной связи участвуют f-орбитали, то координационное число повышается до 12, как, например, в соединении K9[Bi(SCN)12].
На основании рассмотренного можно сделать следующие выводы.
1. В одной и той же группе периодической системы при переходе от предыдущего элемента к последующему координационное число может возрастать, хотя числовая валентность, определяемая номером группы, у них одинакова.
2. Химическая связь может возникать за счет непарных электронов, неподеленных пар электронов и свободных орбиталей. Следовательно, привычное представление о валентности, как способности присоединять или замещать определенное число атомов водорода, не вмещает действительной способности атома элемента образовывать связи с атомами, ионами, радикалами и даже нейтральными молекулами.
Число комплексных соединений очень велико; их можно сгруппировать в зависимости от вида координирующихся лигандов. Наиболее изученными типами комплексных соединений являются: оксокомплексы (лиганд - О), аквакомплексы (лиганд - Н2O), аммины, или аммиакаты (NH3), галокомплексы (F-, Сl-, Br-, I-), цианокомплексы (CN-), комплексы с лигандами, содержащими серу [тиомочевина CS(NH2)2, тиосульфат-ион S2O32- и др.].
Обобщая большое число предшествующих исследований, академик А. А. Гринберг в 1951 г. попытался выявить сравнительную способность элементов к комплексообразованию как по группам, так и по периодам системы, и сформулировать общие положения, которые с учетом изменившейся систематики элементов можно свести к следующему.
Наиболее явной способностью к комплексообразованию обладают атомы и ионы элементов середины больших периодов, т. е. d-элементы групп железа, кобальта, никеля, меди и цинка.
Элементы группы В (d-элементы) более склонны к комплексообразованию, чем элементы групп A (s- и р-элементы). Положительные ионы элементов ГА-группы и отрицательные ионы элементов VIIA-группы не обладают склонностью к комплексообразованию (кроме иона Li+, обладающего малым радиусом). Для благородных газов (Хе и Кг) известны некоторые оксокомплексы ([КrO4]2-, [ХеO4]2- и др.).
В группе элементов-аналогов способность к комплексообразованию тем выше, чем больше напряжение поля иона, определяемого отношением заряда иона (е) к квадрату его радиуса, т. е. е/r2. Например, у В3+ комплексообразующие свойства выражены сильнее, чем у Аl3+, так как значения е/r2 отличные и составляют соответственно 56,7 и 11,5. С увеличением Z у элементов I- и IIА-групп склонность к комплексообразованию падает, а в IV-VIA-группах возрастает. У элементов В-групп вертикальное изменение закономерного ослабления или нарастания комплексообразующей способности осложняется вследствие анормального заполнения электронами подуровней ("провал") у атомов некоторых элементов.
Из индивидуальных особенностей комплексообразования можно отметить следующее. У катионов элементов одной и той же группы устойчивость комплексов, содержащих в качестве лигандов ионы CN- и молекулы NH3, изменяется по отношению друг к другу в обратном направлении; специфические свойства иона ртути предопределяют резко выраженную его способность к комплексообразованию с содержащими серу лигандами.
Сандерсон в своей книге "Периодичность химических свойств" сделал попытку представить связь комплексообразующей способности элемента с его положением в периодической системе в виде таблицы. Табл. 41 заимствована из книги Сандерсона, но несколько дополнена и исправлена в соответствии с данными, полученными за последние 8 лет (табл. 41).
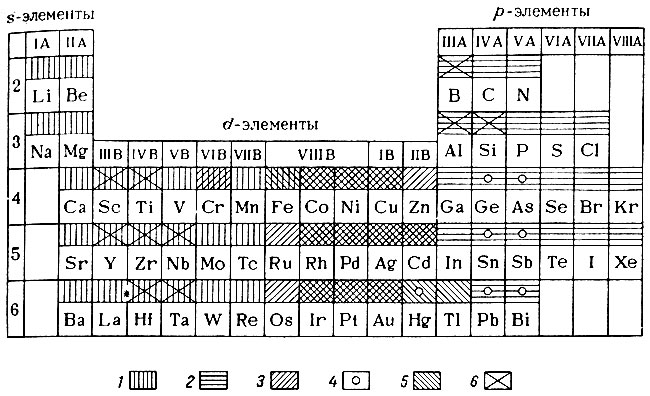
Таблица 41. Наиболее устойчивые комплексные соединения элементов периодической системы Д. И. Менделеева*
1 - чаще всего образуют комплексы с донором О; известны также комплексы с F-; тенденция к координации с другими неметаллами возрастает по периоду слева направо; 2 - известны, главным образом, комплексы с донором О; 3 - известны, главным образом, комплексы с донором N; 4 - образуют устойчивые комплексы с донором S; 5 - образуют устойчивые комплексы, в которых донорами являются: С или Р, редко S, ионы галогенов; тенденция к координации ионов F- и Сl- и других неметаллов по периоду возрастает слева направо; 6 - образуют устойчивые комплексы с F-.
* (Лантаноиды исключены из таблицы.)
В этой таблице отмечены элементы, образующие лишь наиболее устойчивые комплексы. Из нее следует, что d-элементы резко отличаются от s- и р-элементов по своей склонности к образованию комплексов. Это является еще одним аргументом в пользу применения длиннопериодной формы системы по сравнению с короткой формой (лантаноиды и элементы седьмого периода в таблицу не включены).
В будущем предстоит колоссальная работа по изучению связи положения элемента в периодической системе и его комплексообразующей активности, так как комплексные соединения с каждым годом все больше и больше используются в технике и в различных областях науки. Комплексные соединения применяются для изготовления красок, в гальваностегии и гальванопластике для получения прочных защитных и декоративных покрытий на металлах, для разделения ионов редкоземельных элементов-лантаноидов, умягчения воды, в качестве реагентов в аналитической химии, в качестве антидетонаторов моторного топлива, как исходные или промежуточные вещества для получения других веществ и пр. Необходимо отметить, что гемоглобин и хлорофилл, без которых невозможны жизненные функции животных и растительных организмов, являются комплексами железа и магния.
|
ПОИСК:
|
© CHEMLIB.RU, 2001-2021
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://chemlib.ru/ 'Библиотека по химии'